Безводный аммиак
Содержание:
§ 37. Аммиак
Водородное соединение азота аммиак — вещество молекулярного строения. Его структурная формула . В молекуле аммиака, как указано в § 13, имеются три одинарные ковалентные полярные связи, образованные по обменному механизму. Электронная плотность смещена к атому азота, у которого имеется неподелённая пара s-электронов. Поэтому молекула аммиака полярна и имеет конфигурацию тригональной пирамиды (рис. 89).
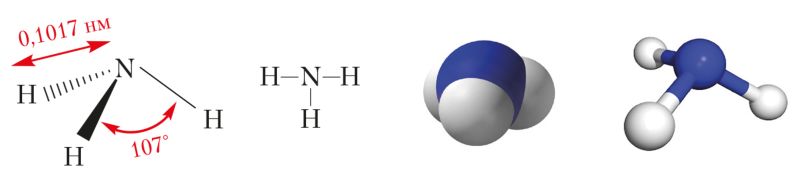 Рис. 89. Пространственная и структурная формулы, масштабная и шаростержневая модели молекулы аммиака
Рис. 89. Пространственная и структурная формулы, масштабная и шаростержневая модели молекулы аммиака
Взаимное отталкивание атомов водорода приводит к увеличению валентного угла между направлениями ковалентных связей N—H от 90° до 107°.
Строение молекулы аммиака. Форма пирамиды в молекуле аммиака и валентный угол 107° при её вершине объясняются образованием связей между гибридными орбиталями атома азота и s-орбиталями атома водорода.
Согласно концепции гибридизации, в образовании ковалентных связей участвуют не исходные валентные три 2p-орбитали внешнего электронного уровня атома азота, а три из четырёх sp3-гибридных орбиталей, схема образования которых показана на рисунке 89.1(а–г).
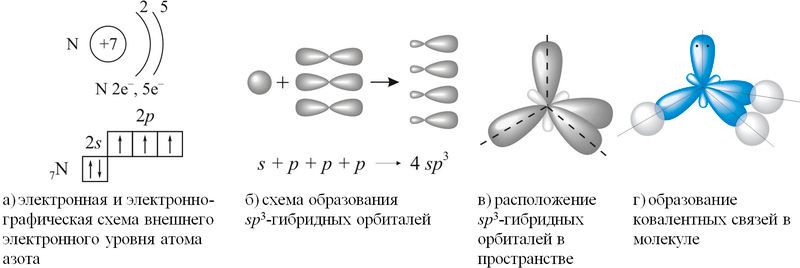 Рис. 89.1. Схема образования ковалентных связей в молекуле аммиака
Рис. 89.1. Схема образования ковалентных связей в молекуле аммиака
Неподелённая электронная пара четвёртой гибридной орбитали обладает незначительной отталкивающей силой, что объясняет уменьшение валентного угла H—N—H со 109,5° до 107. Расположение трёх ковалентных полярных связей под углом приводит к асимметричному распределению электронной плотности, то есть к полярности молекулы:
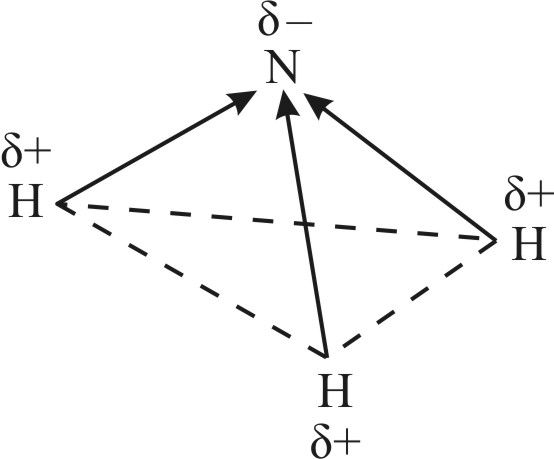
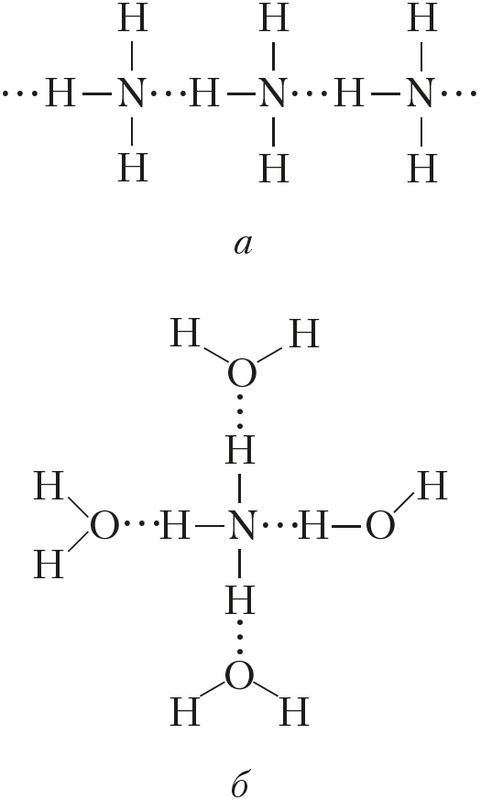 Рис. 90. Водородные связи: а — в жидком аммиаке, б — в водном растворе аммиака
Рис. 90. Водородные связи: а — в жидком аммиаке, б — в водном растворе аммиака
Физические свойства. Аммиак — бесцветный газ (н. у.) с характерным резким запахом (запах нашатырного спирта). Он хорошо растворяется в воде: при 20 °С в одном объёме воды растворяется около 700 объёмов аммиака (сравним: О2 — 0,03, SO2 — 40, НСl — 400 объёмов). Температура кипения аммиака довольно высокая и составляет –33 °С. При небольшом давлении этот газ легко сжижается. Температура плавления — –78 °С, ниже её аммиак существует в виде бесцветных кристаллов. Высокая температура кипения и растворимость в воде обусловлены наличием значительного межмолекулярного взаимодействия, то есть образованием водородных связей как между самими молекулами аммиака (в твёрдом и жидком состояниях), так и между молекулами воды и аммиака (в водном растворе) (рис. 90).
Получение аммиака. Аммиак является одним из ключевых продуктов химической промышленности. Его мировое производство растёт вместе с глобальным спросом на удобрения и в настоящее время превышает 220 млн тонн в год. В Республике Беларусь его производит ОАО «Гродно Азот» — более 1 млн тонн в год.
В промышленности аммиак синтезируют из азота и водорода. Реакция экзотермическая и обратимая, катализатором служит железо, оптимальная температура синтеза — 420–450°С, давление — 30–100 МПа:
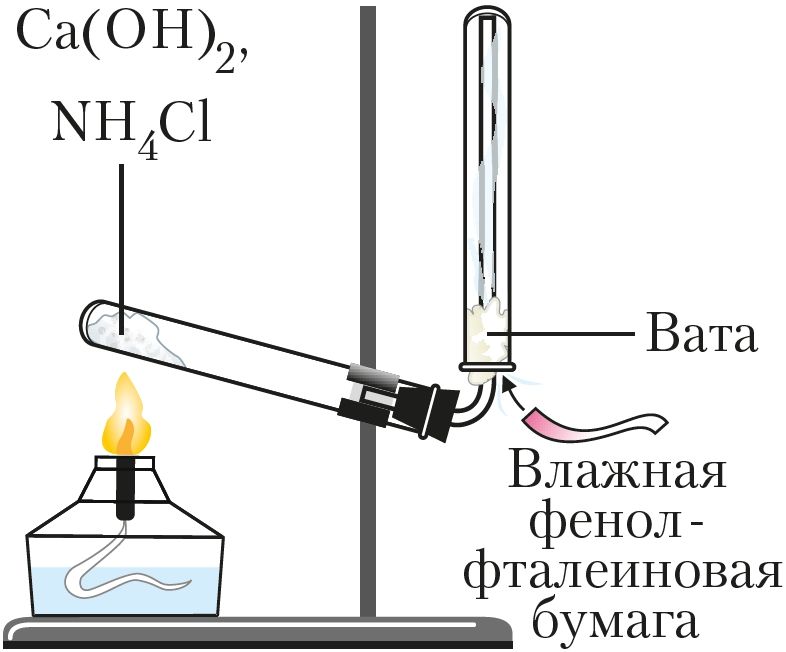 Рис. 91. Получение аммиака в лаборатории
Рис. 91. Получение аммиака в лаборатории
Для получения аммиака в лаборатории нагревают смесь двух твёрдых веществ — хлорида аммония NH4Cl и гидроксида кальция Са(ОН)2 (рис. 91):
Химические свойства. Для аммиака характерны реакции, протекающие как без изменения степени окисления азота, так и окислительно-восстановительные. В первом случае основную роль играет неподелённая электронная пара атома азота. За счёт её образуются новые ковалентные связи по донорно-акцепторному механизму. С другой стороны, наличие атома азота в низшей степени окисления ‒3 обусловливает реакции только с повышением степени окисления. Это означает, что аммиак проявляет свойства восстановителя.
I. Реакции без изменения степени окисления протекают, если аммиак взаимодействует с водой и кислотами. При этом аммиак проявляет основные свойства.
Растворение аммиака в воде приводит к образованию гидрата аммиака NH3· H2O — слабого основания (рис. 92).
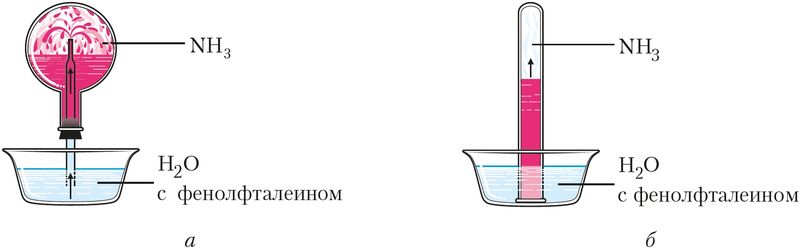 Рис. 92. Растворение аммиака в воде: а — через капилляр — «фонтан», б — в пробирке
Рис. 92. Растворение аммиака в воде: а — через капилляр — «фонтан», б — в пробирке
Водные растворы аммиака имеют щелочную среду (рН > 7) и окрашиваются фенолфталеином в малиновый цвет.
Взаимодействие аммиака с кислотами:
II. Реакции с изменением степени окисления атома азота. Это реакции аммиака как восстановителя. Восстановительные свойства аммиак проявляет в реакциях с кислородом. Состав продуктов зависит от условий проведения реакции. В чистом кислороде и на воздухе он сгорает при нагревании (в смесях — взрывается) с образованием азота и воды, а в присутствии катализаторов (платины, оксидов железа(III) и хрома(III)) образуются оксид азота(II) и вода:
Реакция каталитического окисления аммиака важна как этап его переработки в азотную кислоту.
Статья составлена с использованием следующих материалов:
Вильдфлуш И.Р., Кукреш С.П., Ионас В.А. Агрохимия: Учебник – 2-е изд., доп. И перераб. – Мн.: Ураджай, 2001 – 488 с., ил.
2.
ГОСТ 9 – 92 Аммиак водный технический. Издание официальное. Дата введения 01.01.93
3.
Государственный каталог пестицидов и агрохимикатов, разрешенных к применению на территории Российской Федерации, 2013 год. Министерство сельского хозяйства Российской Федерации (Минсельхоз России)
4.
Минеев В.Г. Агрохимия: Учебник.– 2-е издание, переработанное и дополненное.– М.: Издательство МГУ, Издательство «КолосС», 2004.– 720 с., л. ил.: ил. – (Классический университетский учебник).
5.
Мязин Н.Г. Система удобрения: учебное пособие. – Воронеж: ФГОУ ВПО ВГАУ, 2009.- 350 с
6.
Позин М.Е и др. Технология минеральных солей (удобрений, пестицидов, промышленных солей, окислов и кислот), ч1, издание 4-е исправленное, Л., Издательство Химия, 1974 – 798 стр.
7.
Химическая энциклопедия: в пяти томах: т.1: А-Дарзана/Редкол.: Кнунянц И.Л. (гл. ред.) и др. – М.: Советская энциклопедия, 1988. – 623.: ил
8.
Эндрюс Ю.Б. Применение органических и минеральных удобрений (на разных почвах и под разные культуры). Перевод с английского Т.Л. Чебановой Под редакцией и предисловием академика ВАСХНИЛ проф. Н.С. Соколова. – М.: Издательство иностранной литературы, 1959 г. – 402с.
9.
Ягодин Б.А., Жуков Ю.П., Кобзаренко В.И. Агрохимия / Под редакцией Б.А. Ягодина.– М.: Колос, 2002.– 584 с.: ил (Учебники и учебные пособия для студентов высших учебных заведений).
Изображения (переработаны):
10.
Fertilization, by Howard F. Schwartz, Colorado State University, Bugwood.org, по лицензии CC BY
Свернуть
Список всех источников
Способы получения, уравнение реакции, сфера применения
Существуют разные способы синтеза аммиака. В лабораторных условиях соединение получают путем химической реакции солей аммония со щелочами. Так как аммиак обладает высокой степенью растворимости в воде, чтобы получить чистый аммиак, необходимо использовать твердые вещества.
В процессе синтеза в ступке интенсивно растирают смесь соли аммония и основания, а затем, нагревают смесь. Газ, который выделился в ходе реакции, собирают в пробирку. Так как аммиак легче воздуха, пробирку необходимо перевернуть вверх дном. Определяют присутствие аммиака с помощью влажной лакмусовой бумажки, которая приобретает синюю окраску при контакте с этим веществом.
Другой лабораторный способ получения аммиака заключается в гидролизе нитридов.
В промышленных масштабах аммиак синтезируют с помощью процесса Габера, то есть прямого получения вещества из водорода и азота.
Реакция протекает в условиях температуры 500-550°C и при наличии катализатора. Получение аммиака происходит под давлением 15-30 МПа. Роль катализатора играет губчатое железо с добавками в виде оксидов алюминия, калия, кальция, кремния. Полное использования исходных веществ возможно с помощью методики рециркуляции непровзаимодействовавших реагентов, то есть азот и водород, которые не вступили в химическую реакцию, вновь возвращают в реактор.
Аммиак является токсичным веществом. Несмотря на эту особенность, которую удалось обнаружить ученым, соединение нашло широкое применение в разных сферах хозяйственной деятельности. Большая доля производимого аммиака идет на изготовление разнообразной продукции химической промышленности:
- Аммиачные и аммиачно-нитратные удобрения, в том числе, аммиачная селитра, сульфат аммония, хлористый аммоний. Перечисленные удобрения используют для подкормки сельскохозяйственных культур. В процессе внесения в почву удобрений их количество нормируется, так как содержащиеся в них вещества могут выпадать в осадок и накапливаться в спелых овощах и фруктах.
- Сода. Кальцинированную соду получают с помощью аммиачного метода. Аммиак используют, чтобы насыщать солевой рассол. Рассматриваемый способ распространен в промышленном выпуске соды.
- Азотная кислота. Промышленный процесс производства азотной кислоты основан на каталитическом окислении аммиака.
- Взрывчатые вещества. Нитрат аммония нейтрален к механическому воздействию. С другой стороны, в определенных условиях данное соединение приобретает высокие взрывчатые свойства. Данный факт объясняет его применение в изготовлении зарядов со взрывчатыми веществами. В результате получают аммониты, которые являются аммиачными взрывчатыми веществами.
- Растворитель. Аммиак, пребывая в жидком агрегатном состоянии, подходит для применения в качестве растворителя различных органический и неорганических веществ.
- Аммиачная холодильная установка. Аммиак используют в холодильном оборудовании как хладагент. Вещество не вызывает парниковый эффект и характеризуется более низкой стоимостью по сравнению с фреонами. Данные факторы объясняют популярность аммиака в качестве холодильного агента в промышленных установках.
- Нашатырный спирт (водный раствор аммиака). Данное вещество нашло широкое применение в медицине и в быту. С помощью нашатырного спирта эффективно устраняют пятна с одежды различного происхождения, а также нейтрализуют кислоты.
Аммиак активно применяют в медицинской сфере в определенной концентрации (10% раствор аммиака), который называют нашатырным спиртом. Если человек падает в обморок, с помощью данного вещества его можно привести в чувство. Нашатырный спирт является рвотным средством. С этой целью его разводят водой и в малых количествах принимают внутрь. Данная методика востребована в случае алкогольных отравлений. Из нашатырного спирта делают примочки и обрабатывают ими укусы насекомых. В хирургии разведенным в воде нашатырным спиртом обрабатывают руки.
Аммиак в медицине
В медицине применяют 10% раствор аммиака и нередко выпускают его под названием «нашатырный спирт». Поэтому, если в аптеке вам вместо аммиака предлагают нашатырный спирт, знайте, что это одно и то же.
Раствор прозрачный, имеет резкий запах и быстро испаряется. Поэтому емкость должна плотно закрываться.
Аммиак является стимулятором дыхания, местно-раздражающим средством, антисептиком и дезинфицирующим средством.
Показания к применению:
- обморок (синкопе) и коллапс – для возбуждения дыхания;
- токсическое действие алкоголя – для стимуляции рвоты;
- хирургическая практика – для дезинфекции рук (метод С. И. Спасокукоцкого и И. Г. Кочергина);
- невралгии, миозиты – снятие боли;
- укусы насекомых – как отвлекающее и дезинфицирующее средство.
- наружно – при экземах, дерматитах, кожных заболеваниях;
- повышенная чувствительность к препарату;
- детский возраст – до 3 лет;
- беременность и период грудного вскармливания;
- эпилепсия.
Аммиак 10% (инструкция по применению предупреждает) имеет и некоторые побочные действия:
- Не следует долго дышать испарениями аммиака, это может привести к возникновению головных болей, симптомов интоксикации (тошнота, рвота) и остановке дыхания.
- Не использовать в неразбавленном виде внутрь, это может вызвать отравление и ожог органов пищеварения.
- При наружном применении могут возникнуть раздражение, ожог, аллергическая реакция. В этом случае необходимо прекратить контакт с препаратом и промыть кожу и слизистые большим количеством чистой воды.
Выпускается раствор во флаконах по 10, 40, 100 мл и в ампулах по 1 мл. Флаконы должны плотно закрываться и не пропускать запах аммиака наружу.
Если вы приобрели аммиак в ампулах, инструкция по применению будет отличаться лишь способом вскрытия емкости: необходимо обернуть тонкую горловину ампулы кусочком ваты и затем надломить ее, приложив небольшое усилие.
Отпускается без рецепта врача.
Об основных свойствах аммиака
Разнообразие сфер применения аммиака обусловлено его физическими и химическими свойствами. Аммиак (химическая формула NH3) —бесцветный газ с резким неприятным запахом. При длительном действии на организм человека аммиак вызывает поражение разных органов.
Аммиак вступает в химические реакции с другими элементами и соединениями с образованием новых веществ. Например, в результате реакции безводного аммиака с азотной кислотой получают аммиачную селитру, применяемую в производстве взрывчатых веществ и азотных удобрений.
Аммиак способен восстанавливать различные металлы из их оксидов.
Химические свойства
По свойствам аммиак замечательный растворитель для разнообразных органических и неорганических составов. В твёрдом состоянии представляет собой кристаллы, не имеющие цвета. Может взаимодействовать с кислородом, хлоридом, серной кислотой, а также реагировать на водные и соляные растворы.
Аммиак обладает следующими химическими свойствами:
- Играет роль нуклеофила или комплексообразователя в химических реакциях. При присоединении протона образовывает аммоний: NH3 + H+ → NH4+.
- В жидком растворе происходит слабая щелочная реакция из-за протекающего процесса: NH 3 + H2О → NH4+ +ОН-.
- При воздействии кислот получается соль аммония, что демонстрирует уравнение: NH3 + HNO3 → NH4NO3.
- В соединении с металлами за счет кислотных свойств образует амиды: 2NH3 +2К →2КNH2 +Н2.
Состав амида, имида и нитрида металла образуют за счет реакции с аммиаком в жидком состоянии. Нитрид получают посредством прогревания металла в азотной атмосфере.
Амиды имеют идентичные свойства гидроксидам (за счет неэлектронных ионов ОН, NH2 и молекулы воды). Основание амида сильнее гидроксида, поэтому он подвержен гидролизу, который необратим.
Фенолфталеин в составе раствора приобретает красный оттенок, но после добавления кислот наступает процесс нейтрализации.
Аммиаку в жидком состоянии свойственны ионизирующие функции растворителя, который способен растворить щелочные металлы и щелочноземельные. При этом он приобретает синий цвет. Концентрированный раствор отличается блеском металла. Во время испарения металлы из щелочи получают в целом виде, а щёлочноземельные образуют с аммиаком комплексы со свойствами проводимости металлов.
В результате происходит распадение металлических атомов на ионы, которые положительно заряжены и электроны, сульфатированные в окружении молекул NH 3. Растворы с наличием свободных электронов имеют свойства сильнейших восстановителей.
За счет электронодонорного свойства частицы аммиака могут присутствовать в комплексных соединениях в виде лигандов. Для образования аминокомплексов вводят избыточное количество аммиака в солевой раствор металла.
Физическое воздействие
По физическим свойствам аммиак относится к веществам, обладающим удушающими характеристиками и действием на нервную систему. При попадании в область дыхательных путей способен токсинами поразить легкие и вызвать отек с поражением разных систем живого организма. По виду действия может быть местного применения и резорбтивного.
Аммиачные пары раздражает слизистую оболочку глаза и кожные покровы. Процесс протекает с сильным неприятным запахом. Вследствие воздействия пара происходит обильное выделение слез и боли в области лица. В результате появляется ожог роговицы глаза. Зрение человека ухудшается или происходит полная его потеря. Следом наступает приступ кашля, изменение цвета кожного покрова с сильным раздражением.
Во время попадания раствора на кожу происходит жжение пораженной поверхности и образование пузырей и изъязвлений. По своим свойствам в сжатом состояние во время процесса испарения поглощает тепло. Попадая на кожу, химический элемент способен вызвать отморожение разной степени. Наличие запаха ощущается при концентрации 37 миллиграмм на метр кубический.
Норма концентрации аммиака на рабочем месте не должна превышать 20 миллиграмм на метр кубический. Работать при более тяжелых условиях без средств индивидуальной защиты запрещено.
Насыщенные растворы
Как и другие газы, аммиак проявляет снижение растворимости в жидкостях-растворителях при повышении температуры растворителя. Плотность растворов аммиака уменьшается по мере увеличения концентрации растворенного аммиака. При 15,6 ° C (60,1 ° F) плотность насыщенного раствора составляет 0,88 г / мл, он содержит 35,6% аммиака по массе, 308 г аммиака на литр раствора и имеет молярность приблизительно 18 моль / л. При более высоких температурах молярность насыщенного раствора уменьшается, а плотность увеличивается. При нагревании насыщенных растворов выделяется газообразный аммиак.
Что такое аммиак?
Аммиак — это соединение водорода и азота (один атом азота и три атома водорода, NH 3), которое представляет собой бесцветный газ с резким запахом и хорошо растворяется в воде.
Аммиак образуется естественным образом в результате микробиологического распада азотсодержащих веществ (животного и растительного белка). Также его производят для добавления в удобрения или для изготовления пластика, фармацевтических препаратов и других химических веществ.
Наличие аммиака в грунтовой воде является нормальным явлением, которое объясняется микробиологическими процессами. Однако присутствие аммиачного азота в поверхностной воде обычно указывает на загрязнение бытовыми отходами. Избыток аммиака может навредить растительности и является чрезвычайно токсичным для водных организмов, особенно при повышенном уровне pH и температуры.
Водный раствор аммиака
В различных областях применения аммиак растворяют в воде для производства водного раствора аммиака. Нерасфасованный водный раствор аммиака нестабилен, и концентрация аммиака может снизиться во время транспортировки или хранения. В связи с этим плату за доставленные растворы назначают в соответствии с концентрацией аммиака, поставленного на предприятие или конечному пользователю.
Что такое аммоний?
Аммоний — это соединение, содержащее один атом азота и четыре атома водорода (NH 4+). Хотя аммиак представляет собой нейтральную неионизированную молекулу (слабое основание), аммоний — это ион с положительным зарядом. Кроме того, аммиак имеет сильный запах, а у аммония запах совсем отсутствует.
Основным фактором, определяющим соотношение аммиака и аммония в воде, является уровень pH. Активность аммиака также зависит от ионной силы и температуры раствора
Важно помнить, что ион аммония в основном безопасен несмотря на то, что молекулярный аммиак может быть вреден для водных организмов. В водной промышленности необходимо знать концентрацию соединения азота и водорода
Таким образом, термины «аммиак» и «аммоний» взаимозаменяемы и имеют обозначения NH 3-N и NH 4-N соответственно, а их концентрация обычно выражается в мг/л или ppm N.
Уравнение химической реакции, которое демонстрирует взаимосвязь между аммиаком и аммонием: NH 3 + H 2O <-> NH 4+ + OH —
При низком уровне pH равновесие переходит вправо, а при высоком уровне pH — влево. Как правило, при комнатной температуре и уровне pH менее 6 почти весь аммиачный азот присутствует в виде NH 44 +, а часть в виде NH 3 очень мала. При pH около 8 доля NH 3 составляет 10% или меньше, а при pH немного выше 9 — около 50%. При уровне pH > 11 все ионы аммония в растворе преобразуются в молекулярную форму аммиака. При низких температурах активность водного аммиака значительно ниже.
Быстрые ссылки
Почему нужно выполнять мониторинг аммиака?
Аммиак используется как реагент и как параметр измерения в нескольких областях очистки воды и сточных вод.
- В заборной воде выполняют мониторинг аммиака, который образуется естественным образом.
- При хлораммонизации аммиак используется совместно с хлором для очистки питьевой воды и долгосрочного поддержания остаточного уровня в системах распределения.
- Иногда аммиак используется для контроля pH (например, в фармацевтической промышленности).
- Мониторинг аммиака часто выполняют в процессах нитрификации и денитрификации сточных вод.
Несмотря на что низкие концентрации аммиака неопасны, высокие концентрации аммиака могут привести к повреждениям и создать опасность для здоровья. По этой причине необходимо надлежащим образом контролировать и поддерживать ПДК аммонийного азота.
Компания Hach предлагает аналитическое оборудование, информационные ресурсы, обучение и программное обеспечение для успешного мониторинга и контроля аммиака в необходимой области применения.
Инструкция по применению
Нашатырь выпускается в нескольких формах:
- стеклянные флаконы от 10 до 100 мл для наружного применения;
- ампулы по 1 мл (10% водный раствора аммиака).
Хранят препарат в затемненных прохладных местах. Годность ампулы составляет 5 лет, флаконов — 2 года.
Показания к применению препарата
- Ингаляционно — для возбуждения дыхания, а также для быстрого выведения человека из обморочного состояния.
- Наружно — при обработке рук в хирургической практике и для обеззараживания кожи, чтобы устранить зуд после укусов различных насекомых.
- Внутрь — исключительно как рвотное средство.
Фармакодинамика препарата
При вдыхании нашатырного спирта препарат воздействует на рецепторы верхних путей дыхательной системы. При этом задействован рефлекторно-дыхательный центр. Также препарат рефлекторно оказывает воздействие на работу сердца и тонус сосудов.
Во время применения препарата внутрь возбуждается рвотный центр, за счет чего становится возможным опорожнение органов пищеварительной системы от токсинов.
При нанесении на кожу препарата, осуществляется отвлекающее действие через кожные рецепторы. Препарат подавляет очаг возбуждения, снижает боль и напряжение мышц, купирует спазмы тканей. На месте соприкосновения с препаратом разражаются рецепторы кожи, что и провоцирует высвобождение активных веществ. Благодаря этому происходит расширение сосудов, ускоряется процесс регенерации и питания тканей, нормализуется отток метаболитов.
Правила применения
В медицинской практике часто используется такой спирт для оказания раздражающего воздействие на рецепторы слизистой носа при обмороках, а также алкогольных отравлениях. Чтобы правильно использовать препарат, придерживайтесь следующей инструкции:
- Для нормализации дыхания и приведения человека “в чувства” при обмороке, к ноздрям пациента поднесите кусочек ваты, смоченной раствором аммиака.
- При алкогольном отравлении можно дать потерпевшему выпить нашатырь, но только в разведенном виде. Пропорции: на стакан воды — 5-6 капель.
- Как отхаркивающее средство используйте нашатырно-анисовые капли. Этот комбинированный препарат включает в себя раствор аммиака, этиловый спирт и анисовое масло. Рекомендуемая дневная доза:
- Для взрослых — до 15 капель (не более 5 капель дважды-трижды в сутки).
- Детям до 1 года — максимум по 1 капле, можно до 2 раз в день.
- Для провоцирования рвоты используйте препарат в разведенном виде: 5-7 капель препарата на полстакана воды.
- Для мытья рук в хирургической практике средство также применяйте в разведенном виде: 25 мл препарата на 5 л кипяченой теплой воды.
- Мазь, изготовленную из нашатырного спирта и ланолина в равных количествах, применяют для купирования неприятных симптомов после укусов насекомых.
Меры предосторожности
- Вдыхание паров раствора аммиака, нашатырного спирта в больших количествах может спровоцировать остановку дыхания и нарушение сердечного ритма.
- Если препарат в больших концентрациях принять внутрь, то появятся следующие симптомы: боль в животе, расстройство работы кишечника, рвота, судороги.
- Если передозировка произошла при ингаляции, то возможны насморк, кашель, оттек гортани, остановка дыхания.
- При наружном применении передозировка чревата ожогами.
Первая помощь при отравлении:
- При отравлении аммиаком пострадавшего необходимо вынести на свежий воздух, горло, нос, рот тщательно промыть водой. Для большей эффективности в воду добавьте глютаминовую или лимонную кислоту.
- При пропадании препарата на открытый участок тела, обильно промойте поврежденную кожу водой и накройте повязкой. Применять любые мази в течение 24 часов не рекомендуется, а в дальнейшем проведите терапевтическую обработку такую же, как и при термических ожогах.
- Если аммиак, нашатырный спирт высокой концентрации, попал в пищеварительный тракт, то хорошенько промойте желудок. Пострадавшему дайте выпить несколько белков от яиц, ложку растительного масла, стакан молока. Если есть возможность — сделайте клизму.
- При попадании брызг аммиака в глаза, немедленно промойте их проточной водой. После этого нанесите на пораженное место на коже вазелиновое или оливковое масло и закапайте глаза 0,5 % раствором дикаина, а при необходимости накройте глаза повязкой.



