Химические и физические свойства аммиака
Содержание:
- Чем отличается аммиак от нашатырного спирта
- Правила применения
- Физические и химические свойства
- Свойства нашатырного спирта
- Статья составлена с использованием следующих материалов:
- Оборудование и арматура, оказывающая наибольшее влияние на безопасность склада жидкого аммиака
- История появления аммиака
- Получение аммиака в промышленности и лаборатории. Химические реакции – уравнения получения аммиака:
- Применение и использование
- Инструкция по применению
- Об основных свойствах аммиака
- Комплексообразование
- Применение и использование
- Нашатырный спирт – что это?
- Аммиак. Опасен при вдыхании и незаменим в промышленности
- Производители аммиака
- § 37. Аммиак
Чем отличается аммиак от нашатырного спирта
Основным отличием NH4OH от нитрида водорода является их агрегатное первоначальное состояние. Аммиак – бесцветный газ, который сжижается при -33 градусах Цельсия. Нашатырный спирт – это жидкость, которую часто называют раствором аммиака. Различием веществ является и область их применения. Аммиак – основной продукт, используемый в химической промышленности. Этот газ часто берут:
- при производстве спирта;
- как хладагент для поддержания работы промышленных, бытовых систем;
- для производства удобрений, полимеров, азотной кислоты, соды;
- при строительстве;
- для изготовления взрывчатых веществ.
Моногидрат аммиака имеет более узкое использование, преимущественно как медицинский антисептик. Кроме того, раствор часто применяют домохозяйки для выведения пятен с одежды, для очищения золота и серебра, как подкорму для садовых и комнатных растений. Основным сходством этих средств считается то, что они способны неприятно пахнуть из-за большого содержания аммиачных солей.
Правила применения
Раствор аммиака – это токсическое вещество, поэтому при его неправильном использовании может возникнуть рефлекторная остановка дыхания, ожог желудка (при приеме неразведенного препарата). Как правило, средство применяют ингаляционно, местно и внутрь. В хирургической практике им моют руки. При продолжительном воздействии препарата на организм, могут появиться некробиотические и воспалительные изменения в тканях.
Перед использованием вещества, следует тщательно ознакомиться с инструкцией или проконсультироваться со специалистом. При случайном повреждении емкости с препаратом следует быстро открыть окно и проветрить помещение. При попадании на слизистые оболочки и в глаза нужно промыть пораженные участки большим количеством проточной воды и обратиться за помощью к врачу.
Аммиак от прыщей
Раствор аммиака – отличное средство при жирной коже лица, которая склонна к возникновению прыщей и черных точек. Он может использоваться для умывания. При этом необходимо половину чайной ложки вещества развести стаканом теплой воды. Кроме того, проблемные участки можно протирать раствором гидроксида аммиака с концентрацией 1-2 % с помощью ватного тампона.
Физические и химические свойства
Безводный аммиак содержит 82,3% азота.
Физические свойства
При атмосферном давлении и обычной температуре жидкий аммиак находится в газообразном состоянии. При температуре +26,7°C один литр весит 600 г и содержит 492 г азота. Понижение температуры приводит к увеличению веса, а повышение – к уменьшению веса. При +2,2°C происходит сжижение газа и образуется жидкий аммиак.
При температуре +100°C безводный аммиак развивает давление 5,1 am, а при +37,8°C – 13,4 am. Жидкий аммиак содержит более 99 % аммиака, большой взрывчатостью не отличается, но воздух, содержащий 16–25 % аммиака, может воспламениться от искры, что провоцирует взрыв. Жидкий аммиак значительно легче воздуха и быстро поднимается вверх, если не прибивается к земле ветром. Горение смеси аммиака с топливными газами приводит к образованию сильно ядовитого газа – синильной кислоты.
Аммиак хорошо растворяется в воде: один объем воды при +20°C растворяет 702 объема аммиака при парциальном давлении NH3, равном атмосферному.
При хранении в герметичных сосудах под давлением он разделяется на две фазы: жидкую и газообразную. Пары безводного аммиака обладают большой упругостью, поэтому емкости для его транспортировки и хранения должны заполняться не полностью.
Свойства нашатырного спирта
Во время процесса дыхания пары гидроксида аммиака попадают внутрь организма, при этом вещество активно начинает взаимодействовать с тройничным нервом, при этом рефлекторно возбуждая дыхательный центр. Концентрированный раствор способен вызывать колликвацию (растворение, размягчение) белков микробных клеток. Средство еще часто применяется как скорая помощь для возбуждения дыхания и выведения человека из обморочного состояния. Кроме того, аммиачный раствор:
- при наружном применении улучшает регенерацию тканей, расширяет сосуды, стимулирует отток метаболитов;
- обладает антисептическим действием;
- оказывает раздражающее воздействие на экстерорецепторы кожи;
- блокируют поток болевых импульсов из патологических очагов;
- провоцирует местное высвобождение кининов, простагландинов;
- влияет на деятельность сердца и тонус сосудистых стенок;
- снижает гипералгезию, напряжение мышц, спазмы, оказывая отвлекающее действие;
- при вдыхании препарата происходит увеличение кровяного давления;
- подавляет очаги возбуждения;
- способствует быстрому выходу мокроты;
- воздействуя на рвотный центр, повышает возбудимость;
- прием внутрь в малых дозах стимулирует секрецию желез.
Статья составлена с использованием следующих материалов:
Вильдфлуш И.Р., Кукреш С.П., Ионас В.А. Агрохимия: Учебник – 2-е изд., доп. И перераб. – Мн.: Ураджай, 2001 – 488 с., ил.
2.
ГОСТ 9 – 92 Аммиак водный технический. Издание официальное. Дата введения 01.01.93
3.
Государственный каталог пестицидов и агрохимикатов, разрешенных к применению на территории Российской Федерации, 2013 год. Министерство сельского хозяйства Российской Федерации (Минсельхоз России)
4.
Минеев В.Г. Агрохимия: Учебник.– 2-е издание, переработанное и дополненное.– М.: Издательство МГУ, Издательство «КолосС», 2004.– 720 с., л. ил.: ил. – (Классический университетский учебник).
5.
Мязин Н.Г. Система удобрения: учебное пособие. – Воронеж: ФГОУ ВПО ВГАУ, 2009.- 350 с
6.
Позин М.Е и др. Технология минеральных солей (удобрений, пестицидов, промышленных солей, окислов и кислот), ч1, издание 4-е исправленное, Л., Издательство Химия, 1974 – 798 стр.
7.
Химическая энциклопедия: в пяти томах: т.1: А-Дарзана/Редкол.: Кнунянц И.Л. (гл. ред.) и др. – М.: Советская энциклопедия, 1988. – 623.: ил
8.
Эндрюс Ю.Б. Применение органических и минеральных удобрений (на разных почвах и под разные культуры). Перевод с английского Т.Л. Чебановой Под редакцией и предисловием академика ВАСХНИЛ проф. Н.С. Соколова. – М.: Издательство иностранной литературы, 1959 г. – 402с.
9.
Ягодин Б.А., Жуков Ю.П., Кобзаренко В.И. Агрохимия / Под редакцией Б.А. Ягодина.– М.: Колос, 2002.– 584 с.: ил (Учебники и учебные пособия для студентов высших учебных заведений).
Изображения (переработаны):
10.
Fertilization, by Howard F. Schwartz, Colorado State University, Bugwood.org, по лицензии CC BY
Свернуть
Список всех источников
Оборудование и арматура, оказывающая наибольшее влияние на безопасность склада жидкого аммиака
Основное оборудование
Главным фактором безопасной эксплуатации склада жидкого аммиака является выбор и установка проверенного, надежного, с большим временем межремонтного пробега оборудования. К такому оборудованию следует отнести сам ИР, компрессорное оборудование, насосы выдачи жидкого аммиака, стендеры слива-налива на железнодорожных и авто-эстакадах.
Компрессорное оборудование
ИР оснащается системой дублирования компрессоров, состоящих из одного рабочего компрессора и одного резервного.
Для сжатия газообразного аммиака в последнее время ОАО «НИАП» рекомендует использовать винтовые компрессорные агрегаты с масляным заполнением и с регулированием производительности от 10 до 100%. Температура газа на всасывании компрессора от –30 до +30°С.
Насосы выдачи жидкого аммиака из ИР
Это – вертикальные аммиачные центробежные насосы, выбор которых по напору и производительности осуществляется по ТУ промплощадки, материальное исполнение – коррозионно-стойкая сталь. Установка – на наружной площадке.
Стендеры для отгрузки продукта в транспорт
Стендеры – это рычажно-шарнирные механизмы, предназначенные для верхнего слива-налива цистерн.
В заключение хотелось бы подчеркнуть, что проектирование любого склада жидкого аммиака является индивидуальной разработкой, и ОАО «НИАП» готово оказать услуги по проектированию всей инфраструктуры СЖА.
История появления аммиака
Впервые аммиак получил в 1774 году английский химик Джозефом Пристли. Открытый им газ получил название “щелочного воздуха”, так как химический состав химик, а одновременно и священник, определить не смог. Лишь спустя 11 лет (в 1785 году) Клод Луи Бертолле — известный французский химик определил химический состав газа и назвал его аммиаком (NH3).
На счет того, почему газ назвали именно так, имеется две версии:
- одну связывают с именем бога древних египтян — Амоном;
- вторую — со сходным по звучанию оазиса в районе северной Африки — “Аммона”.
По первой версии, люди, поклоняющиеся богу Амону, во время обряда нюхали нашатырный спирт.
Согласно второй — в оазисе Аммона, который находится на перекрестке караванных путей, из-за нахождения огромного количества вьючных животных, скапливались продукты их жизнедеятельности. При условиях жаркого климата мочевина имеет свойство быстро разлагаться и выделять газ, названный аммиаком.
Какая из двух версий достоверная и правильная — неизвестно и по сей день.
Получение аммиака в промышленности и лаборатории. Химические реакции – уравнения получения аммиака:
Аммиак в лабораторных условиях получается в результате следующих химических реакций:
- 1. действия гидроксида натрия на хлорид аммония:
NH4Cl + NaOH → NH3 + NaCl + H2O.
В результате реакции образуются газообразный аммиак, хлорид натрия и вода.
- 2. действия гидроксида кальция на сульфат аммония:
(NH4)2SO4 + Ca(OH)2 → 2NH3 + CaSO4 + 2H2O.
В результате реакции образуются газообразный аммиак, сульфат кальция и вода.
- 3. действия гидроксида кальция на хлорид аммония:
NH4Cl + Ca(OH)2→ 2NH3 + CaCl2 + 2H2O.
В результате реакции образуются газообразный аммиак, хлорид кальция и вода.
Таким образом, для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония.
Аммиак в промышленности получают путем прямого взаимодействия водорода и азота:
N2 + 3H2 2NH3 (kat = пористое железо с примесями Al2O3 и K2O, t = 500 оС, p = 350 атм.).
За счет высокого давления равновесие в указанной реакции смещается в сторону аммиака. Это так называемый процесс Габера. Немецкий физик Фриц Габер разработал физико-химические основы метода.
Применение и использование
Аммиак входит в большое количество веществ в промышленности. Объемы изготовления этого химического элемента достигают 150 миллионов тонн. Чаще всего производят:
- азотные удобрения (аммоний и мочевина);
- вещества на взрывчатой основе;
- азотные кислоты.
Возможно применение аммиака в роли растворителя. В холодильной промышленности встречается в виде холодильного агента (R 717).
В области медицины аммиак или нашатырный спирт (более привычное название — нашатырь) выводит человека из состояния обморока, стимулирует рвотный рефлекс. Для наружного применения используют в качестве обеззараживания укусов насекомых и при обрабатывании рук врачей
При неосторожном использовании возможно получить ожог органов пищеварения, остановку работы легких.
Применение при дерматите, кожных заболеваниях, а также повреждениях кожи в результате травмы категорически запрещено. Местное использование разрешено на здоровой области кожи. При неаккуратном применении и попадании раствора на слизистую часть глазного яблока следует обработать пострадавшую область водой или борной кислотой. Обработку необходимо повторять каждые 10 минут.
Промышленное применение аммиака
Основная доля производимого технического аммиака используется в химической промышленности:
- для получения аммиачных и аммиачно-нитратных удобрений (аммиачной и нитратной селитры, хлористого аммония, сульфата аммония и других), широко используемых в сельскохозяйственном производстве при выращивании различных культур, а также в частном садоводстве и огородничестве;
- при получении соды аммиачно-хлоридным способом аммиаком насыщают концентрированный солевой раствор, через который под давлением пропускают двуокись углерода;
- синтетический аммиак применяется при производстве азотной кислоты, методом катализа;
- для получения аммонитов — аммиачных взрывчатых веществ;
- жидкий аммиак используют в качестве растворителя разных неорганических и органических веществ;
- в холодильных установках жидкий аммиак применяют в качестве хладагента R717;
- в качестве окислителя ракетного топлива.
Применение аммиака в медицине
Аммиак широко применяется в медицине в качестве 10% -ого раствора аммиака и имеет название – нашатырный спирт. Когда человек падает в обморок, нашатырным спиртом приводят его в чувство. Также его используют как рвотное средство. Для этого его разводят и в малых количествах принимают внутрь. Особенно популярный такой метод при алкогольных отравлениях. Из нашатырного спирта делают примочки и обрабатывают укусы насекомых. Хирурги используют разведенный в воде нашатырный спирт для обработки рук.
Важно помнить, что передозировка аммиаком очень опасна. Возможны болевые ощущения в различных органах, их отеки и даже летальный исход
Этого можно избежать, если использовать данное вещество по назначению и с осторожностью!
Инструкция по применению
Нашатырь выпускается в нескольких формах:
- стеклянные флаконы от 10 до 100 мл для наружного применения;
- ампулы по 1 мл (10% водный раствора аммиака).
Хранят препарат в затемненных прохладных местах. Годность ампулы составляет 5 лет, флаконов — 2 года.
Показания к применению препарата
- Ингаляционно — для возбуждения дыхания, а также для быстрого выведения человека из обморочного состояния.
- Наружно — при обработке рук в хирургической практике и для обеззараживания кожи, чтобы устранить зуд после укусов различных насекомых.
- Внутрь — исключительно как рвотное средство.
Фармакодинамика препарата
При вдыхании нашатырного спирта препарат воздействует на рецепторы верхних путей дыхательной системы. При этом задействован рефлекторно-дыхательный центр. Также препарат рефлекторно оказывает воздействие на работу сердца и тонус сосудов.
Во время применения препарата внутрь возбуждается рвотный центр, за счет чего становится возможным опорожнение органов пищеварительной системы от токсинов.
При нанесении на кожу препарата, осуществляется отвлекающее действие через кожные рецепторы. Препарат подавляет очаг возбуждения, снижает боль и напряжение мышц, купирует спазмы тканей. На месте соприкосновения с препаратом разражаются рецепторы кожи, что и провоцирует высвобождение активных веществ. Благодаря этому происходит расширение сосудов, ускоряется процесс регенерации и питания тканей, нормализуется отток метаболитов.
Правила применения
В медицинской практике часто используется такой спирт для оказания раздражающего воздействие на рецепторы слизистой носа при обмороках, а также алкогольных отравлениях. Чтобы правильно использовать препарат, придерживайтесь следующей инструкции:
- Для нормализации дыхания и приведения человека “в чувства” при обмороке, к ноздрям пациента поднесите кусочек ваты, смоченной раствором аммиака.
- При алкогольном отравлении можно дать потерпевшему выпить нашатырь, но только в разведенном виде. Пропорции: на стакан воды — 5-6 капель.
- Как отхаркивающее средство используйте нашатырно-анисовые капли. Этот комбинированный препарат включает в себя раствор аммиака, этиловый спирт и анисовое масло. Рекомендуемая дневная доза:
- Для взрослых — до 15 капель (не более 5 капель дважды-трижды в сутки).
- Детям до 1 года — максимум по 1 капле, можно до 2 раз в день.
- Для провоцирования рвоты используйте препарат в разведенном виде: 5-7 капель препарата на полстакана воды.
- Для мытья рук в хирургической практике средство также применяйте в разведенном виде: 25 мл препарата на 5 л кипяченой теплой воды.
- Мазь, изготовленную из нашатырного спирта и ланолина в равных количествах, применяют для купирования неприятных симптомов после укусов насекомых.
Меры предосторожности
- Вдыхание паров раствора аммиака, нашатырного спирта в больших количествах может спровоцировать остановку дыхания и нарушение сердечного ритма.
- Если препарат в больших концентрациях принять внутрь, то появятся следующие симптомы: боль в животе, расстройство работы кишечника, рвота, судороги.
- Если передозировка произошла при ингаляции, то возможны насморк, кашель, оттек гортани, остановка дыхания.
- При наружном применении передозировка чревата ожогами.
Первая помощь при отравлении:
- При отравлении аммиаком пострадавшего необходимо вынести на свежий воздух, горло, нос, рот тщательно промыть водой. Для большей эффективности в воду добавьте глютаминовую или лимонную кислоту.
- При пропадании препарата на открытый участок тела, обильно промойте поврежденную кожу водой и накройте повязкой. Применять любые мази в течение 24 часов не рекомендуется, а в дальнейшем проведите терапевтическую обработку такую же, как и при термических ожогах.
- Если аммиак, нашатырный спирт высокой концентрации, попал в пищеварительный тракт, то хорошенько промойте желудок. Пострадавшему дайте выпить несколько белков от яиц, ложку растительного масла, стакан молока. Если есть возможность — сделайте клизму.
- При попадании брызг аммиака в глаза, немедленно промойте их проточной водой. После этого нанесите на пораженное место на коже вазелиновое или оливковое масло и закапайте глаза 0,5 % раствором дикаина, а при необходимости накройте глаза повязкой.
Об основных свойствах аммиака
Разнообразие сфер применения аммиака обусловлено его физическими и химическими свойствами. Аммиак (химическая формула NH3) —бесцветный газ с резким неприятным запахом. При длительном действии на организм человека аммиак вызывает поражение разных органов.
Аммиак вступает в химические реакции с другими элементами и соединениями с образованием новых веществ. Например, в результате реакции безводного аммиака с азотной кислотой получают аммиачную селитру, применяемую в производстве взрывчатых веществ и азотных удобрений.
Аммиак способен восстанавливать различные металлы из их оксидов.
Химические свойства
По свойствам аммиак замечательный растворитель для разнообразных органических и неорганических составов. В твёрдом состоянии представляет собой кристаллы, не имеющие цвета. Может взаимодействовать с кислородом, хлоридом, серной кислотой, а также реагировать на водные и соляные растворы.
Аммиак обладает следующими химическими свойствами:
- Играет роль нуклеофила или комплексообразователя в химических реакциях. При присоединении протона образовывает аммоний: NH3 + H+ → NH4+.
- В жидком растворе происходит слабая щелочная реакция из-за протекающего процесса: NH 3 + H2О → NH4+ +ОН-.
- При воздействии кислот получается соль аммония, что демонстрирует уравнение: NH3 + HNO3 → NH4NO3.
- В соединении с металлами за счет кислотных свойств образует амиды: 2NH3 +2К →2КNH2 +Н2.
Состав амида, имида и нитрида металла образуют за счет реакции с аммиаком в жидком состоянии. Нитрид получают посредством прогревания металла в азотной атмосфере.
Амиды имеют идентичные свойства гидроксидам (за счет неэлектронных ионов ОН, NH2 и молекулы воды). Основание амида сильнее гидроксида, поэтому он подвержен гидролизу, который необратим.
Фенолфталеин в составе раствора приобретает красный оттенок, но после добавления кислот наступает процесс нейтрализации.
Аммиаку в жидком состоянии свойственны ионизирующие функции растворителя, который способен растворить щелочные металлы и щелочноземельные. При этом он приобретает синий цвет. Концентрированный раствор отличается блеском металла. Во время испарения металлы из щелочи получают в целом виде, а щёлочноземельные образуют с аммиаком комплексы со свойствами проводимости металлов.
В результате происходит распадение металлических атомов на ионы, которые положительно заряжены и электроны, сульфатированные в окружении молекул NH 3. Растворы с наличием свободных электронов имеют свойства сильнейших восстановителей.
За счет электронодонорного свойства частицы аммиака могут присутствовать в комплексных соединениях в виде лигандов. Для образования аминокомплексов вводят избыточное количество аммиака в солевой раствор металла.
Физическое воздействие
По физическим свойствам аммиак относится к веществам, обладающим удушающими характеристиками и действием на нервную систему. При попадании в область дыхательных путей способен токсинами поразить легкие и вызвать отек с поражением разных систем живого организма. По виду действия может быть местного применения и резорбтивного.
Аммиачные пары раздражает слизистую оболочку глаза и кожные покровы. Процесс протекает с сильным неприятным запахом. Вследствие воздействия пара происходит обильное выделение слез и боли в области лица. В результате появляется ожог роговицы глаза. Зрение человека ухудшается или происходит полная его потеря. Следом наступает приступ кашля, изменение цвета кожного покрова с сильным раздражением.
Во время попадания раствора на кожу происходит жжение пораженной поверхности и образование пузырей и изъязвлений. По своим свойствам в сжатом состояние во время процесса испарения поглощает тепло. Попадая на кожу, химический элемент способен вызвать отморожение разной степени. Наличие запаха ощущается при концентрации 37 миллиграмм на метр кубический.
Норма концентрации аммиака на рабочем месте не должна превышать 20 миллиграмм на метр кубический. Работать при более тяжелых условиях без средств индивидуальной защиты запрещено.
Комплексообразование
Благодаря своим электронодонорным свойствам молекулы NH3 могут входить в качестве лиганда в комплексные соединения. Так, введение избытка аммиака в растворы солей d-металлов приводит к образованию их аминокомплексов:
-
- CuSO4 + 4NH3 ⟶ [Cu(NH3)4]SO4.
- Ni(NO3)2 + 6NH3 ⟶ [Ni(NH3)6](NO3)2.
Комплексообразование обычно сопровождается изменением окраски раствора. Так, в первой реакции голубой цвет (CuSO4) переходит в тёмно-синий (окраска комплекса), а во второй реакции окраска изменяется из зелёной ( Ni(NO3)2 ) в сине-фиолетовую. Наиболее прочные комплексы с NH3 образуют хром и кобальт в степени окисления +3.
Применение и использование
Аммиак входит в большое количество веществ в промышленности. Объемы изготовления этого химического элемента достигают 150 миллионов тонн. Чаще всего производят:
- азотные удобрения (аммоний и мочевина);
- вещества на взрывчатой основе;
- азотные кислоты.
Возможно применение аммиака в роли растворителя. В холодильной промышленности встречается в виде холодильного агента (R 717).
В области медицины аммиак или нашатырный спирт (более привычное название — нашатырь) выводит человека из состояния обморока, стимулирует рвотный рефлекс. Для наружного применения используют в качестве обеззараживания укусов насекомых и при обрабатывании рук врачей
При неосторожном использовании возможно получить ожог органов пищеварения, остановку работы легких
Применение при дерматите, кожных заболеваниях, а также повреждениях кожи в результате травмы категорически запрещено. Местное использование разрешено на здоровой области кожи. При неаккуратном применении и попадании раствора на слизистую часть глазного яблока следует обработать пострадавшую область водой или борной кислотой. Обработку необходимо повторять каждые 10 минут.
Нашатырный спирт – что это?
Аммиак или нашатырный спирт
очень хорошее азотистое соединение, обладающее самой легкой и доступной формой азота для растений. Продается в аптеках в бутылочках по 40 мл, прозрачная жидкость с резким запахом, концентрация 10% — обычный медицинский нашатырный спирт (бывает концентрированный 25% раствор аммиака).
Применение нашатырного спирта, в отличие от других азотных удобрений, дает сразу положительный эффект, который можно увидеть через 4-5 дней после полива, растения преобразятся и оживут, зазеленеют. Растения начинают быстро расти, вредители, находящиеся в земле погибают.
Азот очень важный элемент для растений, способствует фотосинтезу. При недостатке азота растения болеют, нарушается выработка хлорофилла. Листья теряют окраску, начинают желтеть. Бутоны и цветы осыпаются.
Азот необходим всем, без исключения, растениям, только в разном количестве.
Запах аммиака способен отпугнуть таких вредителей
как луковая муха, морковная муха, тля, скрытнохоботник, медведка, проволочник, муравьи, мошки обитающие на комнатных растениях.
Домашние цветы
поливают, разводя нашатырь в пропорции 1 ст. л. на 10 литров воды.
Внимание: не превышайте дозы и делайте перерывы в 2 недели между применением нашатырного спирта
Аммиак. Опасен при вдыхании и незаменим в промышленности
При отравлении аммиаком необходимо принять следующие меры:
Первая медицинская помощь: промыть глаза и лицо водой, надеть противогаз или ватно-марлевую повязку, смоченную 5% раствором лимонной кислоты, открытые участки кожи обильно промыть водой, немедленно покинуть очаг заражения.
Индивидуальная защита: изолирующий и фильтрующие противогазы марок М, КД, респиратор РПГ-67КД, при их отсутствии — ватно-марлевая повязка, смоченная 5% раствором лимонной кислоты, защитный костюм, резиновые сапоги, перчатки.
Действия общего характера: удалить посторонних. Держаться с наветренной стороны.
Изолировать опасную зону и не допускать посторонних. В зону аварии входить только в полной защитной одежде. Соблюдать меры пожарной безопасности, не курить.
При утечке и разливе: устранить источники открытого огня. Устранить течь. Для осаждения газов использовать распыленную воду. Оповестить об опасности отравления местные органы власти. Эвакуировать людей из зоны, подвергшейся опасности заражения ядовитым газом. Не допускать попадания вещества в водоемы, тоннели, подвалы, канализацию. В случае загрязнения воды сообщить СЭС.
При пожаре: убрать из зоны пожара, если это не представляет опасности, и дать возможность догореть. Не приближаться к горящим емкостям. Охлаждать емкости водой с максимального расстояния. Тушить распыленной водой, воздушно-механической пеной с максимального расстояния.
Случаи утечки аммиака
В декабре 1999 года в Калининградской области в приграничном с Литвой городе Советске на целлюлозно-бумажном комбинате произошла авария, в результате которой из резервуаров на почву вытекло более 100 тонн аммиачной воды.
В мае 2000 года в Черкасской области Украины в результате железнодорожной аварии из двух вагонов-цистерн вылилось около 100 тонн аммиачной воды.
В апреле 2001 года на холодильной установке в колбасном цехе ОАО «Поиск» в Томске произошел взрыв емкости с аммиаком. В момент взрыва в цехе находились 40 человек, шестеро из них получили ранения.
В сентябре 2005 года произошел аварийный выброс аммиака на Калининградском мясокомбинате.
В июле 2006 аварийный выброс аммиака произошел в г. Корсакове Сахалинской области. На территории предприятия «Корсаковский рыбоконсервный завод» при замене сальника на вентиле трубопровода, соединяющего емкость для хранения аммиака с компрессором, произошел выброс аммиака в объеме до 70 кг. В результате выброса пострадало 3 человека.
В январе 2007 года на северо-востоке Москвы три человека пострадали в результате утечки аммиака. На территории завода железобетонных конструкций были обнаружены 20 баллонов с аммиаком. Из баллона, в котором еще находился аммиак, произошла утечка, и образовалось небольшое аммиачное облако.
В феврале 2007 года в Дзержинске Нижегородской области произошел выброс аммиака из теплообменника в цехе этанол-амина ООО «Синтез-Ока». Утечка произошла в результате разгерметизации фланцевого соединения аппарата Т-12, предназначенного для испарения аммиака.
Области применения аммиака
Аммиак — один из самых важных продуктов химической промышленности.
Большая часть получаемого в промышленности аммиака идёт на приготовление азотной кислоты, азотных удобрений, красителей. Применяется аммиак и для получения взрывчатых веществ. Широко используются водные растворы аммиака. Как слабое летучее основание, он применяются в химических лабораториях и производствах. С помощью аммиака получают пищевую соду.
В медицине 10% водный раствор аммиака известен как нашатырный спирт. Резкий запах аммиака раздражает специфические рецепторы слизистой оболочки носа и способствует возбуждению дыхательного и сосудодвигательного центров, поэтому при обморочных состояниях или алкогольном отравлении пострадавшему дают вдыхать пары нашатырного спирта.
При пайке металлов используют хлорид аммония — нашатырь — NH4Сl. При высокой температуре нашатырь разлагается с образованием аммиака, который очищает поверхности паяльника и спаиваемого изделия от оксидов металлов.
При испарении жидкого аммиака поглощается большое количество теплоты, поэтому его используют в холодильных установках.
Все справки>>
Производители аммиака
Производители аммиака в России
| Компания | 2006, тыс. т | 2007, тыс. т |
|---|---|---|
| ОАО «Тольяттиазот» | 2 634 | 2 403,3 |
| ОАО НАК «Азот» | 1 526 | 1 514,8 |
| ОАО «Акрон» | 1 526 | 1 114,2 |
| ОАО «Невинномысский азот», г. Невинномысск | 1 065 | 1 087,2 |
| ОАО «Минудобрения» (г. Россошь) | 959 | 986,2 |
| ОАО «АЗОТ» г. Кемерово | 854 | 957,3 |
| ОАО «Азот» | 869 | 920,1 |
| ОАО «ЗМУ КЧХК» | 956 | 881,1 |
| ОАО Череповецкий «Азот» | 936,1 | 790,6 |
| ЗАО «Куйбышевазот» | 506 | 570,4 |
| ОАО «Газпром Нефтехим Салават» | 492 | 512,8 |
| «Минеральные удобрения» (г. Пермь) | 437 | 474,6 |
| ОАО «Дорогобуж» | 444 | 473,9 |
| ОАО «Воскресенские минеральные удобрения» | 175 | 205,3 |
| ОАО «Щекиноазот» | 58 | 61,1 |
| АО «Аммоний» (г. Менделеевск) | — | — |
| Итого | 13 437,1 | 12 952,9 |
На долю России приходится около 9 % мирового выпуска аммиака. Россия — один из крупнейших мировых экспортёров аммиака. На экспорт поставляется около 25 % от общего объёма производства аммиака, что составляет около 16 % мирового экспорта.
По итогам 2014 года в России было произведено 14,8 млн тонн аммиака (+2 % к 2013 году) (по данным Росстата). Производство аммиака в России сконцентрировано в Приволжском федеральном округе (46 % по итогам 2014 года). Далее следуют Центральный федеральный округ (23 %) и Северо-Западный федеральный округ (16 %).
Порядка 25 % российского производства аммиака отправляется на экспорт. Так, в 2014 году объём российского экспорта аммиака (по данным ФТС) составил составил 3,6 млн тонн (+6 % к 2013 году) на сумму 1,6 млрд долл. США.
Ключевыми странами-получателями в 2014 году стали Украина, Финляндия и Литва.
Производители аммиака на Украине
| Компания | 2008 |
|---|---|
| ПАО «Концерн Стирол» | 1 331 |
| Одесский припортовый завод | 1 128 |
| Северодонецкое объединение Азот | 1 015 |
| «Азот» (Черкассы) | 778 |
| «Днепроазот» | 515 |
| «Ровноазот» | 382 |
| Итого | 5 149 |
§ 37. Аммиак
Водородное соединение азота аммиак — вещество молекулярного строения. Его структурная формула . В молекуле аммиака, как указано в § 13, имеются три одинарные ковалентные полярные связи, образованные по обменному механизму. Электронная плотность смещена к атому азота, у которого имеется неподелённая пара s-электронов. Поэтому молекула аммиака полярна и имеет конфигурацию тригональной пирамиды (рис. 89).
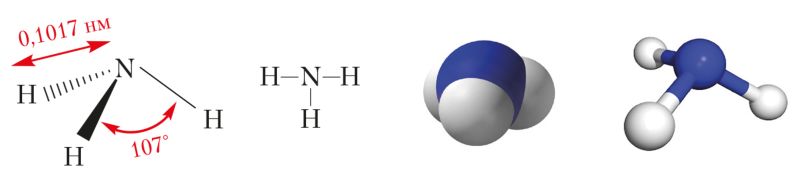 Рис. 89. Пространственная и структурная формулы, масштабная и шаростержневая модели молекулы аммиака
Рис. 89. Пространственная и структурная формулы, масштабная и шаростержневая модели молекулы аммиака
Взаимное отталкивание атомов водорода приводит к увеличению валентного угла между направлениями ковалентных связей N—H от 90° до 107°.
Строение молекулы аммиака. Форма пирамиды в молекуле аммиака и валентный угол 107° при её вершине объясняются образованием связей между гибридными орбиталями атома азота и s-орбиталями атома водорода.
Согласно концепции гибридизации, в образовании ковалентных связей участвуют не исходные валентные три 2p-орбитали внешнего электронного уровня атома азота, а три из четырёх sp3-гибридных орбиталей, схема образования которых показана на рисунке 89.1(а–г).
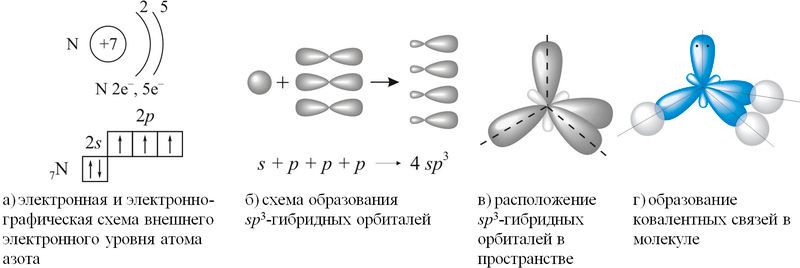 Рис. 89.1. Схема образования ковалентных связей в молекуле аммиака
Рис. 89.1. Схема образования ковалентных связей в молекуле аммиака
Неподелённая электронная пара четвёртой гибридной орбитали обладает незначительной отталкивающей силой, что объясняет уменьшение валентного угла H—N—H со 109,5° до 107. Расположение трёх ковалентных полярных связей под углом приводит к асимметричному распределению электронной плотности, то есть к полярности молекулы:
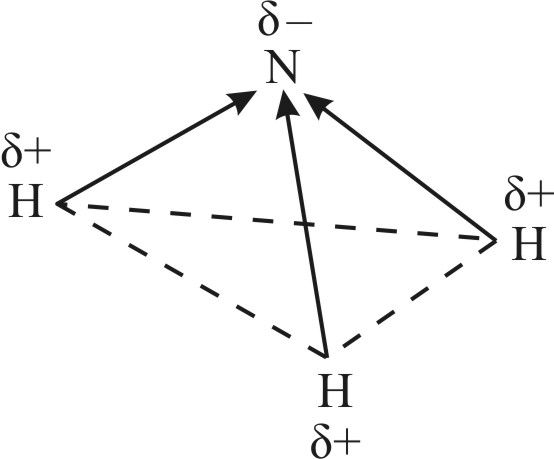
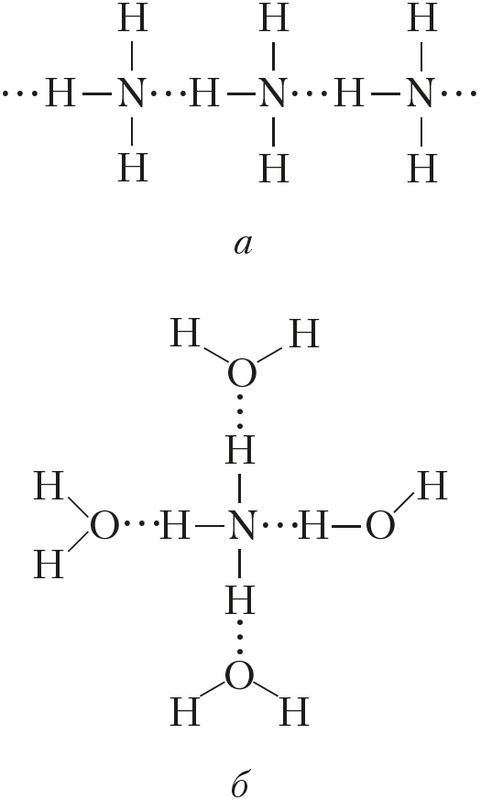 Рис. 90. Водородные связи: а — в жидком аммиаке, б — в водном растворе аммиака
Рис. 90. Водородные связи: а — в жидком аммиаке, б — в водном растворе аммиака
Физические свойства. Аммиак — бесцветный газ (н. у.) с характерным резким запахом (запах нашатырного спирта). Он хорошо растворяется в воде: при 20 °С в одном объёме воды растворяется около 700 объёмов аммиака (сравним: О2 — 0,03, SO2 — 40, НСl — 400 объёмов). Температура кипения аммиака довольно высокая и составляет –33 °С. При небольшом давлении этот газ легко сжижается. Температура плавления — –78 °С, ниже её аммиак существует в виде бесцветных кристаллов. Высокая температура кипения и растворимость в воде обусловлены наличием значительного межмолекулярного взаимодействия, то есть образованием водородных связей как между самими молекулами аммиака (в твёрдом и жидком состояниях), так и между молекулами воды и аммиака (в водном растворе) (рис. 90).
Получение аммиака. Аммиак является одним из ключевых продуктов химической промышленности. Его мировое производство растёт вместе с глобальным спросом на удобрения и в настоящее время превышает 220 млн тонн в год. В Республике Беларусь его производит ОАО «Гродно Азот» — более 1 млн тонн в год.
В промышленности аммиак синтезируют из азота и водорода. Реакция экзотермическая и обратимая, катализатором служит железо, оптимальная температура синтеза — 420–450°С, давление — 30–100 МПа:
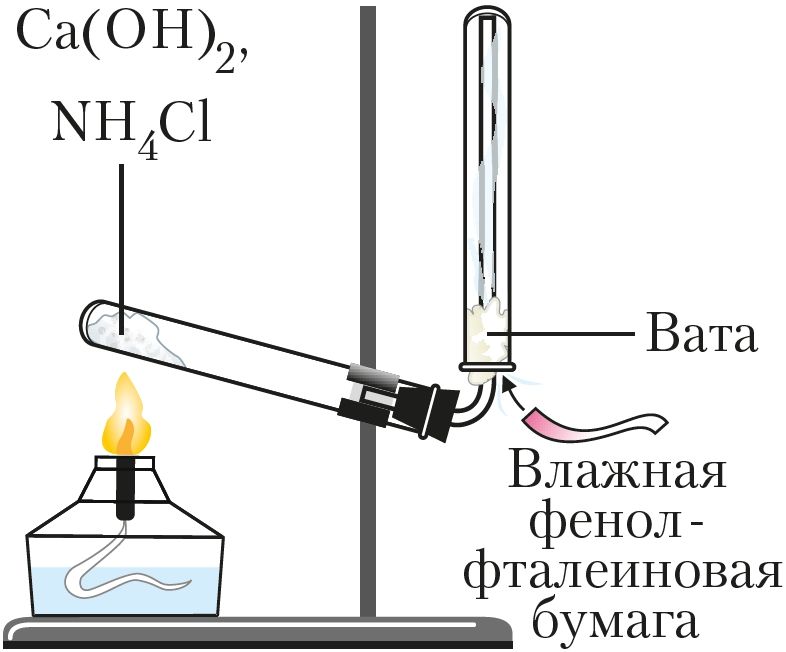 Рис. 91. Получение аммиака в лаборатории
Рис. 91. Получение аммиака в лаборатории
Для получения аммиака в лаборатории нагревают смесь двух твёрдых веществ — хлорида аммония NH4Cl и гидроксида кальция Са(ОН)2 (рис. 91):
Химические свойства. Для аммиака характерны реакции, протекающие как без изменения степени окисления азота, так и окислительно-восстановительные. В первом случае основную роль играет неподелённая электронная пара атома азота. За счёт её образуются новые ковалентные связи по донорно-акцепторному механизму. С другой стороны, наличие атома азота в низшей степени окисления ‒3 обусловливает реакции только с повышением степени окисления. Это означает, что аммиак проявляет свойства восстановителя.
I. Реакции без изменения степени окисления протекают, если аммиак взаимодействует с водой и кислотами. При этом аммиак проявляет основные свойства.
Растворение аммиака в воде приводит к образованию гидрата аммиака NH3· H2O — слабого основания (рис. 92).
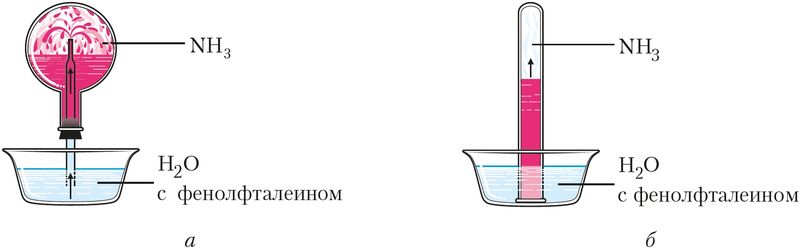 Рис. 92. Растворение аммиака в воде: а — через капилляр — «фонтан», б — в пробирке
Рис. 92. Растворение аммиака в воде: а — через капилляр — «фонтан», б — в пробирке
Водные растворы аммиака имеют щелочную среду (рН > 7) и окрашиваются фенолфталеином в малиновый цвет.
Взаимодействие аммиака с кислотами:
II. Реакции с изменением степени окисления атома азота. Это реакции аммиака как восстановителя. Восстановительные свойства аммиак проявляет в реакциях с кислородом. Состав продуктов зависит от условий проведения реакции. В чистом кислороде и на воздухе он сгорает при нагревании (в смесях — взрывается) с образованием азота и воды, а в присутствии катализаторов (платины, оксидов железа(III) и хрома(III)) образуются оксид азота(II) и вода:
Реакция каталитического окисления аммиака важна как этап его переработки в азотную кислоту.



