Влияние аммиака на окружающую среду
Содержание:
- Отравление парами аммиака
- Что делать после отравления?
- Откуда берется аммиак
- Правила оказания первой помощи при интоксикации
- § 37. Аммиак
- Статья составлена с использованием следующих материалов:
- Дополнительные методы лечения: за и против
- Лечение
- Первая помощь при отравлении химическими веществами бытового назначения, которые попали на кожу:
- Профилактические меры
- Аммиак в медицине
- Популярные статьи
- Применение нашатырного спирта
- Аммиак. Опасен при вдыхании и незаменим в промышленности
- Чем опасен аммиак
Отравление парами аммиака
Следует знать, что нашатырный спирт очень опасен при длительном вдыхании его паров
То есть в стремлении привести пьяного человека или человека без сознания в чувство с помощью нашатыря, важно не переусердствовать. Безопасным считается вдыхание паров нашатыря в течение 2-3 секунд
Длительное вдыхание паров приводит к отравлению. И чем более долгим будет воздействие паров аммиака на организм человека, тем более тяжелым в итоге будет его состояние. Симптомами отравления парами нашатырного спирта являются:
- Бледность кожных покровов;
- Ступорное состояние больного;
- Увеличение пульса до отметки 180 уд/мин.
Важно: если на этом этапе нейтрализовать источник паров аммиака, то больной способен прийти к нормальному состоянию без тяжелых последствий. Однако в большинстве случаев все же отмечается повреждение слизистого слоя легких
Более длительное вдыхание паров нашатыря приводит к таким последствиям:
- Кашель и состояние удушья;
- Спазм бронхов;
- Хрип и свистящие шумы в легких;
- Нарушение зрения;
- Расстройство координации движений;
- Бредовое состояние;
- Панические атаки;
- Болезненность в области сердца;
- Пульс 140 уд/мин;
- Рвота и постоянная тошнота;
- Потеря сознания.
Если продолжить воздействие паров аммиака на организм человека, то больной, в конце концов, впадёт в кому. В этом случае без медицинской помощи пациент умирает.
Важно: с особой осторожностью контактировать с аммиаком нужно людям, которые имеют в анамнезе аллергические расстройства или болезни сердечнососудистой системы. Шанс отравиться нашатырем у таких людей в разы выше
Оказание первой помощи при отравлении аммиачными парами
Чтобы помочь такому больному, необходимо предпринять ряд таких мер:
- Убрать источник испарения нашатырного спирта;
- Освободить верхнюю часть тела от стягивающей одежды (галстук, ворот рубахи, сдавливающий бюстгальтер и пр.);
- Обеспечить приток воздуха в помещение (или вынести больного на балкон/улицу).
Считается, что если в течение нескольких минут больной пришёл в сознание, то степень отравления была лёгкой, а значит, медицинская помощь не требуется. Если же больной все ещё находится без сознания, то необходимо вызывать парамедиков. Без их помощи не обойтись.
Что делать после отравления?
После отравления человека госпитализируют, и он находится в токсикологическом отделении. 24 часа после отравления за самочувствием пациента наблюдают специалисты. Больному назначается постельный режим, даже если симптоматика уже отсутствует. Если симптомы все же наблюдаются, проводится симптоматическая терапия.
Если у пациента ярко выраженный ларингоспазм, проводят трахеостомию
Также проводится комплексное лечение ожогов на коже, большое внимание уделяется роговице. В профилактических целях выписываются антибиотики и иные лекарственные препараты, которые предотвращают развитие пневмонии и других болезней внутренних органов
Откуда берется аммиак

Свыше 70% удобрений не усваивается растениями в Китае
Что приводит в частности, вот к таким последствиям. Но про воду и автоматическое измерение общего азота, в другой раз!
Животноводческие фермы являются одним из основных источников выбросов аммиака в Европе, удобрения, транспорт, различные химические вещества (например стеклоочистители). Аммиак выделяют животные — свиньи, коровы. По данным National Geographic до 70% соединений азота попадает в почву, воду и атмосферный воздух из удобрений. В Китае считается нормой расход 1 тонны удобрений на гектар.
В России я думаю немного другой расклад, в крупных городах конечно преобладает транспорт. У нас также есть несколько крупных аммиачных заводов (например, Куйбышев, Невинномысск, Дорогобуж), вокруг которых я думаю аммиачный фон значительно превосходит требования установленные ВОЗ для «чувствительных эко систем».
Правила оказания первой помощи при интоксикации
Первая помощь при отравлении АХОВ зависит от путей поступления в организм веществ и состояния пациента – сохранения сознания и наличия тяжелых нарушений.
Первоочередно нужно определить, какой фактор взывает отравление и прервать дальнейшее поступление ядов – применить противогаз, вызвать рвоты при пищевом факторе, защита от оседающих на кожу химикатов путем специальных защитных костюмов. При наличии поражений внешних покровов и кожи избавиться от зараженной одежды, смыть яды с поверхности туловища.
Медикаментозная поддержка, врачебная помощь являются неотъемлемой частью лечения поражений от АХОВ и реабилитации человека после отравлений ядохимикатами.
При вдыхании
Алгоритм первой помощи при поражении АХОВ с преимущественно воздушно-капельным типом передачи состоит в следующих пунктах:
- применить противогаз или ватно-марлевую повязку, смоченную 5% раствором лимонной кислоты или водой, выполняют для защиты от дальнейшего отравления;
- постараться как можно дальше вывезти пострадавшего из очага аварии;
- провести санацию дыхательных путей промыванием носа солевыми растворами (натрия хлорида, Аквамарис, Маример) и полоскание рта антисептиками (слабый раствор Хлоргексидина, Фурацилин);
- дать противоядие при определении конкретного вида яда, иначе отравление грозит серьезными осложнениями;
- провести полную санитарную обработку человека с утилизаций потенциально опасных предметов одежды;
- при отсутствии дыхания провести сердечно-легочные реанимационные мероприятия;
- при возможности обеспечение кислородной маской.
Дыхательный вид АХОВ встречается наиболее часто, ПМП оказывается бригадой скорой помощи прибывшей в зону заражения.
Загрузка …
При попадании на кожу
При поражении кожно-нарывными видами АХОВ следует придерживаться алгоритма оказания первой помощи при отравлении:
- санация кожи, одежды с помощью специальных дегазирующих средств ПМП;
- под проточной водой тщательно промыть слизистые глаз, рта, ушей;
- в глаза закапать Альбуцид для профилактики поражений глазного аппарата;
- под душем с применением специальных моющих средств провести обработку всего тела;
- смена одежды, нательного белья.
При возникновении ран или высыпаний при АХОВ проводят дополнительно анализы крови для определения аллергической реакции и нарушений иммунной системы вследствие отравления.
При употреблении внутрь
В случае употребления в пищу зараженной продукции АХОВ стоит незамедлительно принять меры ПМП:
- тщательно прополоскать рот;
- вызвать рвоту или применить зонд у младшей возрастной группы;
- провести очищение кишечника путем сифонной клизмы и промывания до чистых вод, при необходимости дают слабительное – Бисакодил, Дуфалак;
- принять абсорбирующие лекарственные средства – Белый уголь, активированный уголь, Смекта, Энтеросгель;
- много пить чистой питьевой воды для дезинтоксикации.
При пищевом отравлении АХОВ необходимо сохранить остатки пищи для лабораторного исследования.
Отравление аварийно-химическими опасными веществами представляет угрозу для здоровья человека и при возникновении такой ситуации стоит незамедлительно госпитализировать пострадавших для оказания адекватной терапии, терапии сопутствующих нарушений организма при АХОВ.
Статья была одобрена редакцией
§ 37. Аммиак
Водородное соединение азота аммиак — вещество молекулярного строения. Его структурная формула . В молекуле аммиака, как указано в § 13, имеются три одинарные ковалентные полярные связи, образованные по обменному механизму. Электронная плотность смещена к атому азота, у которого имеется неподелённая пара s-электронов. Поэтому молекула аммиака полярна и имеет конфигурацию тригональной пирамиды (рис. 89).
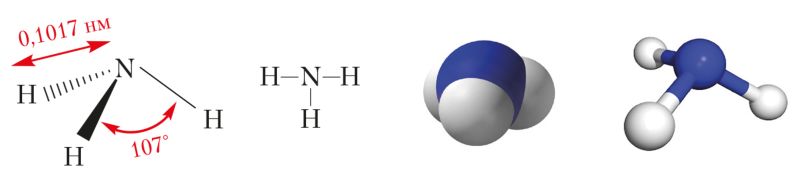 Рис. 89. Пространственная и структурная формулы, масштабная и шаростержневая модели молекулы аммиака
Рис. 89. Пространственная и структурная формулы, масштабная и шаростержневая модели молекулы аммиака
Взаимное отталкивание атомов водорода приводит к увеличению валентного угла между направлениями ковалентных связей N—H от 90° до 107°.
Строение молекулы аммиака. Форма пирамиды в молекуле аммиака и валентный угол 107° при её вершине объясняются образованием связей между гибридными орбиталями атома азота и s-орбиталями атома водорода.
Согласно концепции гибридизации, в образовании ковалентных связей участвуют не исходные валентные три 2p-орбитали внешнего электронного уровня атома азота, а три из четырёх sp3-гибридных орбиталей, схема образования которых показана на рисунке 89.1(а–г).
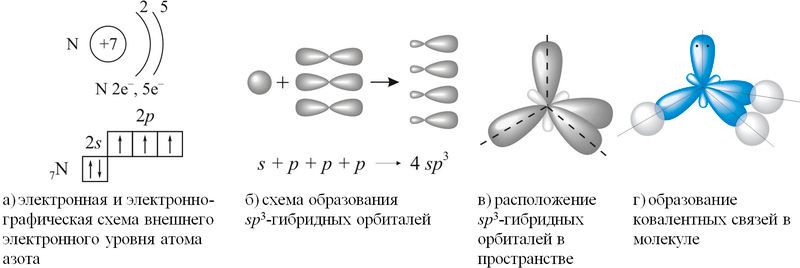 Рис. 89.1. Схема образования ковалентных связей в молекуле аммиака
Рис. 89.1. Схема образования ковалентных связей в молекуле аммиака
Неподелённая электронная пара четвёртой гибридной орбитали обладает незначительной отталкивающей силой, что объясняет уменьшение валентного угла H—N—H со 109,5° до 107. Расположение трёх ковалентных полярных связей под углом приводит к асимметричному распределению электронной плотности, то есть к полярности молекулы:
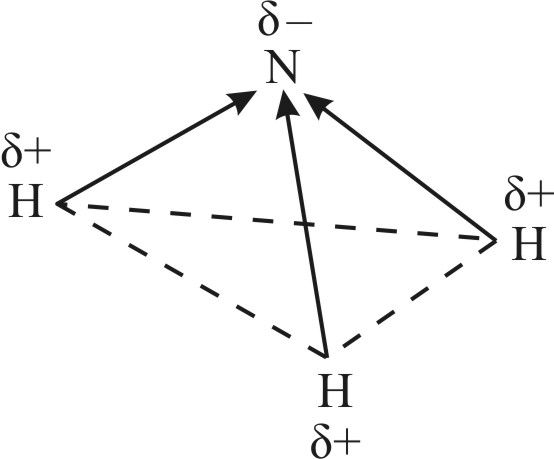
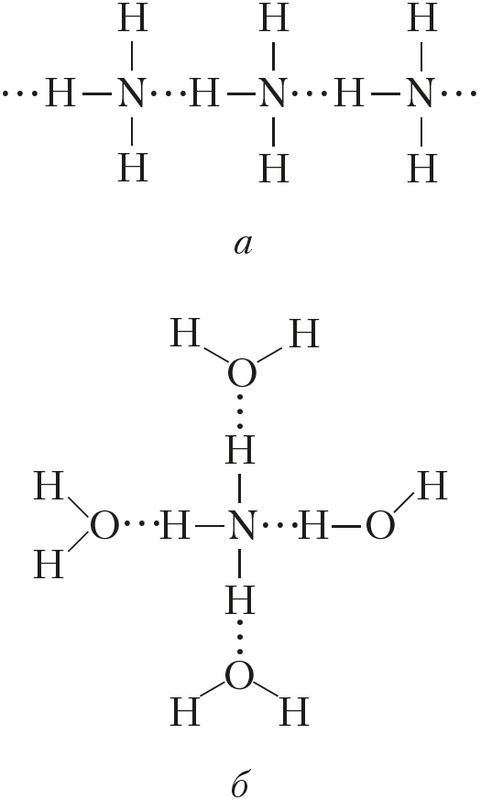 Рис. 90. Водородные связи: а — в жидком аммиаке, б — в водном растворе аммиака
Рис. 90. Водородные связи: а — в жидком аммиаке, б — в водном растворе аммиака
Физические свойства. Аммиак — бесцветный газ (н. у.) с характерным резким запахом (запах нашатырного спирта). Он хорошо растворяется в воде: при 20 °С в одном объёме воды растворяется около 700 объёмов аммиака (сравним: О2 — 0,03, SO2 — 40, НСl — 400 объёмов). Температура кипения аммиака довольно высокая и составляет –33 °С. При небольшом давлении этот газ легко сжижается. Температура плавления — –78 °С, ниже её аммиак существует в виде бесцветных кристаллов. Высокая температура кипения и растворимость в воде обусловлены наличием значительного межмолекулярного взаимодействия, то есть образованием водородных связей как между самими молекулами аммиака (в твёрдом и жидком состояниях), так и между молекулами воды и аммиака (в водном растворе) (рис. 90).
Получение аммиака. Аммиак является одним из ключевых продуктов химической промышленности. Его мировое производство растёт вместе с глобальным спросом на удобрения и в настоящее время превышает 220 млн тонн в год. В Республике Беларусь его производит ОАО «Гродно Азот» — более 1 млн тонн в год.
В промышленности аммиак синтезируют из азота и водорода. Реакция экзотермическая и обратимая, катализатором служит железо, оптимальная температура синтеза — 420–450°С, давление — 30–100 МПа:
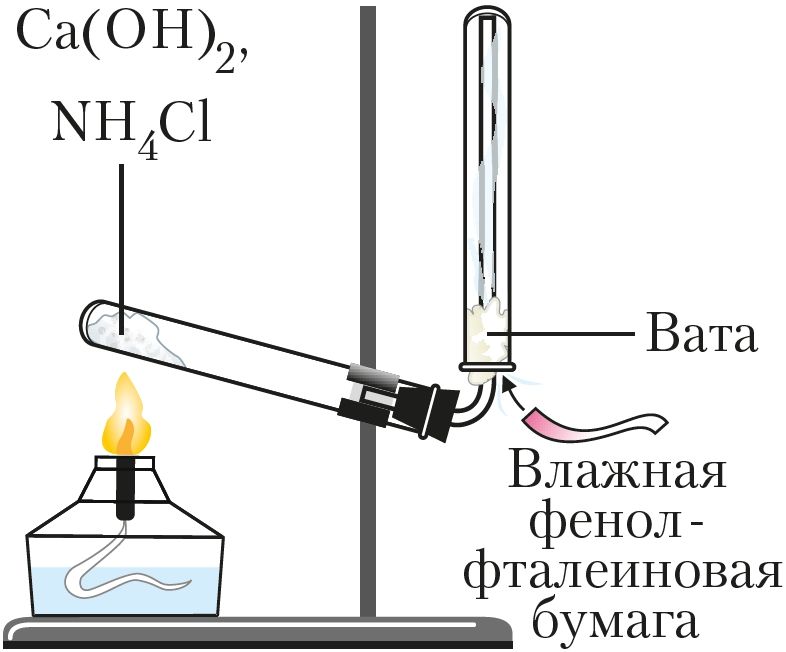 Рис. 91. Получение аммиака в лаборатории
Рис. 91. Получение аммиака в лаборатории
Для получения аммиака в лаборатории нагревают смесь двух твёрдых веществ — хлорида аммония NH4Cl и гидроксида кальция Са(ОН)2 (рис. 91):
Химические свойства. Для аммиака характерны реакции, протекающие как без изменения степени окисления азота, так и окислительно-восстановительные. В первом случае основную роль играет неподелённая электронная пара атома азота. За счёт её образуются новые ковалентные связи по донорно-акцепторному механизму. С другой стороны, наличие атома азота в низшей степени окисления ‒3 обусловливает реакции только с повышением степени окисления. Это означает, что аммиак проявляет свойства восстановителя.
I. Реакции без изменения степени окисления протекают, если аммиак взаимодействует с водой и кислотами. При этом аммиак проявляет основные свойства.
Растворение аммиака в воде приводит к образованию гидрата аммиака NH3· H2O — слабого основания (рис. 92).
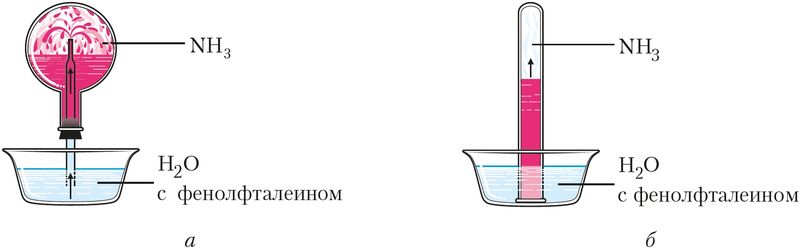 Рис. 92. Растворение аммиака в воде: а — через капилляр — «фонтан», б — в пробирке
Рис. 92. Растворение аммиака в воде: а — через капилляр — «фонтан», б — в пробирке
Водные растворы аммиака имеют щелочную среду (рН > 7) и окрашиваются фенолфталеином в малиновый цвет.
Взаимодействие аммиака с кислотами:
II. Реакции с изменением степени окисления атома азота. Это реакции аммиака как восстановителя. Восстановительные свойства аммиак проявляет в реакциях с кислородом. Состав продуктов зависит от условий проведения реакции. В чистом кислороде и на воздухе он сгорает при нагревании (в смесях — взрывается) с образованием азота и воды, а в присутствии катализаторов (платины, оксидов железа(III) и хрома(III)) образуются оксид азота(II) и вода:
Реакция каталитического окисления аммиака важна как этап его переработки в азотную кислоту.
Статья составлена с использованием следующих материалов:
Вильдфлуш И.Р., Кукреш С.П., Ионас В.А. Агрохимия: Учебник – 2-е изд., доп. И перераб. – Мн.: Ураджай, 2001 – 488 с., ил.
2.
ГОСТ 9 – 92 Аммиак водный технический. Издание официальное. Дата введения 01.01.93
3.
Государственный каталог пестицидов и агрохимикатов, разрешенных к применению на территории Российской Федерации, 2013 год. Министерство сельского хозяйства Российской Федерации (Минсельхоз России)
4.
Минеев В.Г. Агрохимия: Учебник.– 2-е издание, переработанное и дополненное.– М.: Издательство МГУ, Издательство «КолосС», 2004.– 720 с., л. ил.: ил. – (Классический университетский учебник).
5.
Мязин Н.Г. Система удобрения: учебное пособие. – Воронеж: ФГОУ ВПО ВГАУ, 2009.- 350 с
6.
Позин М.Е и др. Технология минеральных солей (удобрений, пестицидов, промышленных солей, окислов и кислот), ч1, издание 4-е исправленное, Л., Издательство Химия, 1974 – 798 стр.
7.
Химическая энциклопедия: в пяти томах: т.1: А-Дарзана/Редкол.: Кнунянц И.Л. (гл. ред.) и др. – М.: Советская энциклопедия, 1988. – 623.: ил
8.
Эндрюс Ю.Б. Применение органических и минеральных удобрений (на разных почвах и под разные культуры). Перевод с английского Т.Л. Чебановой Под редакцией и предисловием академика ВАСХНИЛ проф. Н.С. Соколова. – М.: Издательство иностранной литературы, 1959 г. – 402с.
9.
Ягодин Б.А., Жуков Ю.П., Кобзаренко В.И. Агрохимия / Под редакцией Б.А. Ягодина.– М.: Колос, 2002.– 584 с.: ил (Учебники и учебные пособия для студентов высших учебных заведений).
Изображения (переработаны):
10.
Fertilization, by Howard F. Schwartz, Colorado State University, Bugwood.org, по лицензии CC BY
Свернуть
Список всех источников
Дополнительные методы лечения: за и против
Очищение пазух носа помогает уменьшить скопление слизи и гноя, улучшает их отток. Применяют различные виды препаратов – разжижающих слизь, увлажняющих, противовоспалительных и рефлекторных. Они помогают сделать слизь более жидкой, уменьшить отек слизистой и расширить устье гайморовой пазухи, чтобы секрет быстрее выводился.
Прогревания в острой стадии болезни не применяют потому, что они могут усилить отек, образование гноя и воспаление. Физиотерапевтические и тепловые методики допустимы в стадии выздоровления или при лечении хронического процесса вне обострения. В домашних условиях, без согласования с врачом их лучше не использовать.
Лечение
Лечение отравления нашатырным спиртом проводится под строгим контролем специалистов в стационаре. Оно направлено на избавление от токсинов, снятие боли после ожогов слизистых и кожи:
- Ежедневные ингаляции со специальными растворами, которые увлажняют и обезболивают гортань, бронхи, легкие.
- Прием антибиотиков при попадании инфекции в рану.
- Антисептические компрессы на наружные раны.
- Применение препаратов для регенерации тканей желудка.
- Боли облегчают внутривенным введением Промедола или препаратов на основе морфия.
В домашних условиях человека переводят на специальную диету. Она основывается на употреблении протертых продуктов, исключении жирной, острой и жареной пищи. Следует ежедневно пить более 2 литров очищенной воды, подкисленных соков или клюквенного морса. До выздоровления запрещается принимать алкоголь и курить.
Первая помощь при отравлении химическими веществами бытового назначения, которые попали на кожу:
Обмыть поражённый участок кожи проточной водой и обработать гормональной мазью или мазью с антибиотиком.
Если химические вещества (репелленты, пестициды, гербициды, лаки) случайно попали в пищеварительный тракт, то первая помощь при бытовых отравлениях заключается в скорейшем удалении яда. Это возможно благодаря промыванию желудка, очищению кишечника при помощи клизмы и приему геля от отравления — Энтеросгеля. В качестве обволакивающих средств можно использовать яичный белок или молоко.
Врачи-токсикологи применяют для лечения бытового отравления различные антидоты, например, витамин В6, унитиол и атропин
Вот почему важно срочно обратиться к специалисту!. Чтобы правильно оказать первую помощь при различных отравлениях, не следует:
Чтобы правильно оказать первую помощь при различных отравлениях, не следует:
- Вызывать рвоту у беременных женщин;
- Давать газированную воду;
- Давать слабительные при отравлении средствами бытовой химии, кислотами, щелочами;
- Нейтрализовывать попавшую в желудок кислоту раствором соды;
- Пытаться вызвать рвоту у человека без сознания.
Профилактические меры
На химических предприятиях и заводах нужно в обязательном порядке использовать защитную одежду: надевать резиновые перчатки; специальный костюм; обувать резиновые чеботы. Следует вооружиться противогазом или респиратором.
В случае аварии нужно прикрыть рот и нос влажным полотенцем и как можно скорее покинуть помещение. Наиболее безопасным местом станет подвальное помещение или нижние этажи сооружения. Нитрид водорода во время аварии будет подниматься на верхние этажи, так как соединение имеет плотность меньше плотности кислорода. Если человек почувствовал запах аммиака на улице, нужно прикрыть лицо влажным куском ткани и быстро отойти на безопасное расстояние, чтобы не подвергать своё здоровье риску.
Больше свежей и актуальной информации о здоровье на нашем канале в Telegram. Подписывайтесь: https://t.me/foodandhealthru
Автор статьи:
Дружикина Виктория Юрьевна
Специальность: терапевт, невролог.
Общий стаж: 5 лет.
Место работы: БУЗ ОО «Корсаковская ЦРБ».
Образование: Орловский государственный университет имени И.С. Тургенева.
Другие статьи автора
Будем признательны, если воспользуетесь кнопочками:
Аммиак в медицине
В медицине применяют 10% раствор аммиака и нередко выпускают его под названием «нашатырный спирт». Поэтому, если в аптеке вам вместо аммиака предлагают нашатырный спирт, знайте, что это одно и то же.
Раствор прозрачный, имеет резкий запах и быстро испаряется. Поэтому емкость должна плотно закрываться.
Аммиак является стимулятором дыхания, местно-раздражающим средством, антисептиком и дезинфицирующим средством.
Показания к применению:
- обморок (синкопе) и коллапс – для возбуждения дыхания;
- токсическое действие алкоголя – для стимуляции рвоты;
- хирургическая практика – для дезинфекции рук (метод С. И. Спасокукоцкого и И. Г. Кочергина);
- невралгии, миозиты – снятие боли;
- укусы насекомых – как отвлекающее и дезинфицирующее средство.
- наружно – при экземах, дерматитах, кожных заболеваниях;
- повышенная чувствительность к препарату;
- детский возраст – до 3 лет;
- беременность и период грудного вскармливания;
- эпилепсия.
Аммиак 10% (инструкция по применению предупреждает) имеет и некоторые побочные действия:
- Не следует долго дышать испарениями аммиака, это может привести к возникновению головных болей, симптомов интоксикации (тошнота, рвота) и остановке дыхания.
- Не использовать в неразбавленном виде внутрь, это может вызвать отравление и ожог органов пищеварения.
- При наружном применении могут возникнуть раздражение, ожог, аллергическая реакция. В этом случае необходимо прекратить контакт с препаратом и промыть кожу и слизистые большим количеством чистой воды.
Выпускается раствор во флаконах по 10, 40, 100 мл и в ампулах по 1 мл. Флаконы должны плотно закрываться и не пропускать запах аммиака наружу.
Если вы приобрели аммиак в ампулах, инструкция по применению будет отличаться лишь способом вскрытия емкости: необходимо обернуть тонкую горловину ампулы кусочком ваты и затем надломить ее, приложив небольшое усилие.
Отпускается без рецепта врача.
Популярные статьи
Проезд по ЦКАД — как оплатить, проверить задолженность и не получить штраф
С 2020 года на ЦКАД действует безбарьерная система оплаты — flee flow. Шлагбаумов на трассе нет, но проезд платный. Разобрали как автоматически проверять задолженность и не получать штрафы.
14 мая
158к
Перевозка негабаритных грузов — правила и штрафы для юридических лиц
Разъясняем правила перевозки негабаритных грузов и размеры штрафов для юридических лиц за несоблюдение требований
8 апреля 2020
125к
Штрафы ГИБДД для юридических лиц — как начать контролировать все постановления
Рассказываем как организациям с собственным автопарком проверять штрафы по автомобилям, удобно и быстро оплачивать задолженность по ним, экономить время и деньги при учете и контроле
15 мая 2018
107к
Применение нашатырного спирта
Средство представляет собой растворенный в воде аммиачный газ, который от природы обладает высокой токсичностью и очень ядовит. Нашатырь это аммиак, который не имеет отношения к обычным алкогольным спиртам, не вызывает привычного опьянения. Название получено от латинского spiritus, что означает испарение чего-либо.
Широко применяется нашатырный спирт в медицине для следующих целей:
- При нанесении на кожу в виде раствора снимает зуд после укусов насекомых.
- Резкий запах быстро выводит из обморочного состояния.
- Используется в хирургии для обеззараживания инструментов и поверхностей (в сочетании с другими антисептиками).
- В определенной пропорции помогает убрать последствия отравления алкоголем.
- Добавляется в целебные составы для массажа и растираний при травмах, растяжениях, невралгии.
Не все знают, для чего нужен нашатырь в повседневном быту:
- Отлично выводит пятна с одежды при взаимодействии с другими веществами.
- Используется для ухода за замшей и кожей.
- Добавляется в лакокрасочные изделия, растворители и составы для ремонта.
- Применяется в составе косметических и моющих средств (красок для волос, средства для мытья стекол).
- Помогает освежить внешний вид золотых изделий.
При правильном применении и дозировке нашатырь становится помощником по хозяйству, избавляет от бактерий
При использовании следует соблюдать меры предосторожности и дозировку, не оставлять на видном месте без присмотра
Аммиак. Опасен при вдыхании и незаменим в промышленности
При отравлении аммиаком необходимо принять следующие меры:
Первая медицинская помощь: промыть глаза и лицо водой, надеть противогаз или ватно-марлевую повязку, смоченную 5% раствором лимонной кислоты, открытые участки кожи обильно промыть водой, немедленно покинуть очаг заражения.
Индивидуальная защита: изолирующий и фильтрующие противогазы марок М, КД, респиратор РПГ-67КД, при их отсутствии — ватно-марлевая повязка, смоченная 5% раствором лимонной кислоты, защитный костюм, резиновые сапоги, перчатки.
Действия общего характера: удалить посторонних. Держаться с наветренной стороны.
Изолировать опасную зону и не допускать посторонних. В зону аварии входить только в полной защитной одежде. Соблюдать меры пожарной безопасности, не курить.
При утечке и разливе: устранить источники открытого огня. Устранить течь. Для осаждения газов использовать распыленную воду. Оповестить об опасности отравления местные органы власти. Эвакуировать людей из зоны, подвергшейся опасности заражения ядовитым газом. Не допускать попадания вещества в водоемы, тоннели, подвалы, канализацию. В случае загрязнения воды сообщить СЭС.
При пожаре: убрать из зоны пожара, если это не представляет опасности, и дать возможность догореть. Не приближаться к горящим емкостям. Охлаждать емкости водой с максимального расстояния. Тушить распыленной водой, воздушно-механической пеной с максимального расстояния.
Случаи утечки аммиака
В декабре 1999 года в Калининградской области в приграничном с Литвой городе Советске на целлюлозно-бумажном комбинате произошла авария, в результате которой из резервуаров на почву вытекло более 100 тонн аммиачной воды.
В мае 2000 года в Черкасской области Украины в результате железнодорожной аварии из двух вагонов-цистерн вылилось около 100 тонн аммиачной воды.
В апреле 2001 года на холодильной установке в колбасном цехе ОАО «Поиск» в Томске произошел взрыв емкости с аммиаком. В момент взрыва в цехе находились 40 человек, шестеро из них получили ранения.
В сентябре 2005 года произошел аварийный выброс аммиака на Калининградском мясокомбинате.
В июле 2006 аварийный выброс аммиака произошел в г. Корсакове Сахалинской области. На территории предприятия «Корсаковский рыбоконсервный завод» при замене сальника на вентиле трубопровода, соединяющего емкость для хранения аммиака с компрессором, произошел выброс аммиака в объеме до 70 кг. В результате выброса пострадало 3 человека.
В январе 2007 года на северо-востоке Москвы три человека пострадали в результате утечки аммиака. На территории завода железобетонных конструкций были обнаружены 20 баллонов с аммиаком. Из баллона, в котором еще находился аммиак, произошла утечка, и образовалось небольшое аммиачное облако.
В феврале 2007 года в Дзержинске Нижегородской области произошел выброс аммиака из теплообменника в цехе этанол-амина ООО «Синтез-Ока». Утечка произошла в результате разгерметизации фланцевого соединения аппарата Т-12, предназначенного для испарения аммиака.
Области применения аммиака
Аммиак — один из самых важных продуктов химической промышленности.
Большая часть получаемого в промышленности аммиака идёт на приготовление азотной кислоты, азотных удобрений, красителей. Применяется аммиак и для получения взрывчатых веществ. Широко используются водные растворы аммиака. Как слабое летучее основание, он применяются в химических лабораториях и производствах. С помощью аммиака получают пищевую соду.
В медицине 10% водный раствор аммиака известен как нашатырный спирт. Резкий запах аммиака раздражает специфические рецепторы слизистой оболочки носа и способствует возбуждению дыхательного и сосудодвигательного центров, поэтому при обморочных состояниях или алкогольном отравлении пострадавшему дают вдыхать пары нашатырного спирта.
При пайке металлов используют хлорид аммония — нашатырь — NH4Сl. При высокой температуре нашатырь разлагается с образованием аммиака, который очищает поверхности паяльника и спаиваемого изделия от оксидов металлов.
При испарении жидкого аммиака поглощается большое количество теплоты, поэтому его используют в холодильных установках.
Все справки>>
Чем опасен аммиак
Аммиак, так же как и оксиды серы и азота участвует в формировании различных аэрозолей которые повышают фоновый уровень пыли малых фракций (PM2.5, PM10). Далее аммиак окисляясь превращается в оксиды азота, которые в свою очередь вызывают глобальное потепление.
По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия

Смог от одного из заводов удобрений в США
способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Аммиак обладает как местным, так и резорбтивным действием. Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Вызывают при этом обильное слезотечение, боль в глазах, химический ожог конъюктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи. Запах аммиака ощущается при концентрации 37 мг/м3. Предельно допустимая концентрация в воздухе рабочей зоны производственного помещения составляет 20 мг/м3. Предельно допустимая концентрация аммиака в атмосферном воздухе населённых пунктов равна: среднесуточная 0,04 мг/м3; максимальная разовая 0,2 мг/м3.
Из вышесказанного следует, что если Вы ощущаете запах аммиака, то вы находитесь в зоне где есть превышение ПДК как для рабочей зоны (более чем в два раза), так и для жилой зоны – если по месту жительства вы ощущаете запах аммиака, то у вас превышение нормы минимум в 900 раз.
Всемирная Организация Здравоохранения (ВОЗ) устанавливает лимит для аммиака в 0.01 мг/м3 в “в чувствительных экологических зонах”, то есть в 25 раз ниже чем предельно допустимая концентрация в России.



