Химические свойства соляной кислоты и её применение
Содержание:
Интересные факты
Приведем ряд фактов о хлороводородной кислоте, которые удивят обывателя:
- Хлористый водород способен полностью исправиться. Дело в том, что при высоких температурах соединение переходит в свое основное агрегатное состояние – газообразное и насыщает атмосферу молекулами хлора и водорода.
- Соляная кислота вырабатывается париетальными клетками желудка человеческого организма в небольшой концентрации (0,3%). Она создает необходимую кислотность среды, в которой наиболее активно протекают ферментативные процессы расщепления питательных веществ.
- При пониженной кислотности желудка, в нем развиваются лактобактерии. Данный факт указывает на еще одно свойство HCl – способность уничтожать бактерии. Данное свойство выражает в еще одной её функции в организме человека – бактерицидной.
Соляная кислота Факты
Хлористый водород – это соединение, состоящее из соотношения водорода и хлора один к одному., Без присутствия молекул воды хлористый водород является бесцветным, но токсичным газом. При добавлении воды водород высвобождает многие из своих молекул водорода с образованием сильнокислого раствора. Чуть более 97% молекулярной массы HCl приходится на один хлорид-ион. Этот хлорид-ион имеет атомную массу 35,543, а ион водорода – атомную массу 1,00794. Поскольку имеется только один атом каждого, молярная масса HCl рассчитывается путем сложения этих двух цифр – 36,46094 г / моль. Как уже упоминалось, формулой хлористого водорода является HCl.
В случае молекулярной массы результаты зависят от количества молей HCl. Например, в растворе, где имеется достаточное количество атомов хлористого растворенного газа (Cl2) для числа атомов молекулярного водорода (H2), мы можем с уверенностью сказать, что 4 моля HCl будут давать 4,00 моль HCl.
Используя уравнение Масса HCl = Моль HCl х Молярная масса HCl, мы можем определить, что 4,00 моль х 36,46 г моль-1 составляет 146 г.
Плотность соляной кислоты, pH, температура плавления и температура кипения зависят от концентрации. Например, 10% раствор HCl имеет плотность 1048 кг / л, pH -0,5, температуру плавления -18 ° C и температуру кипения 103 ° C. 30% раствор HCl имеет плотность 1,149 кг / л, pH -1, температуру плавления и кипения -52 ° C и 90 ° C соответственно.
Получение
Соляную кислоту получают растворением газообразного хлороводорода в воде. Хлороводород получают сжиганием водорода в хлоре, полученная таким способом кислота называется синтетической. Также соляную кислоту получают из абгазов — побочных газов, образующихся при различных процессах, например, при хлорировании углеводородов. Хлороводород, содержащийся в этих газах, называется абгазным, а полученная таким образом кислота — абгазной. В последние десятилетия доля абгазной соляной кислоты в объёме производства постепенно увеличивается, вытесняя кислоту, полученную сжиганием водорода в хлоре. Но полученная методом сжигания водорода в хлоре соляная кислота содержит меньше примесей и применяется при необходимости высокой чистоты.
В лабораторных условиях используется разработанный ещё алхимиками способ, заключающийся в действии концентрированной серной кислоты на поваренную соль:
-
- NaCl +H2SO4→150 ∘CNaHSO4 +HCl{\displaystyle {\ce {NaCl\ +H2SO4->NaHSO4\ +HCl}}}.
При температуре выше 550 °C и избытке поваренной соли возможно взаимодействие:
-
- 2NaCl +H2SO4→550 ∘CNa2SO4 +2HCl{\displaystyle {\ce {2NaCl\ +H2SO4->Na2SO4\ +2HCl}}}.
Возможно получение путём гидролиза хлоридов магния, алюминия (нагревается гидратированная соль):
-
- MgCl2⋅6H2O→t, ∘CMgO +2HCl +5H2O{\displaystyle {\ce {MgCl2.6H2O->MgO\ +2HCl\ +5H2O}}},
- AlCl3⋅6H2O→t, ∘CAl(OH)3 +3HCl +3H2O{\displaystyle {\ce {AlCl3.6H2O->Al(OH)3\ +3HCl\ +3H2O}}}.
Эти реакции могут идти не до конца с образованием основных хлоридов (оксихлоридов) переменного состава, например:
-
- 2MgCl2+H2O⟶Mg2OCl2+2HCl{\displaystyle {\ce {2MgCl2 + H2O -> Mg2OCl2 + 2HCl}}}
В промышленности хлороводород получают реакцией горения водорода в хлоре:
H2+Cl2⟶2HCl{\displaystyle {\ce {H2 + Cl2 -> 2HCl}}}
Хлороводород хорошо растворим в воде. Так, при 0 °C 1 объём воды может поглотить 507 объёмов HCl{\displaystyle {\ce {HCl}}}, что соответствует концентрации кислоты 45 %. Однако при комнатной температуре растворимость HCl{\displaystyle {\ce {HCl}}} ниже, поэтому на практике обычно используют 36-процентную соляную кислоту.
Последующее лечение
Первая медицинская помощь оказывается медиками, приехавшими на вызов. Они проводят быстрый осмотр больного и сбор анамнеза, проверяют его жизненные показатели (пульс, артериальное давление, дыхание и сатурацию). Затем они приступают к оказанию первой помощи. Ее объем зависит от способа попадания хлористого водорода в организм и от состояния пациента. Первая медицинская помощь может состоять из следующих компонентов:
- промывания желудка через зонд;
- подключения капельницы с растворами;
- введения обезболивающих препаратов;
- медикаментозной регуляции жизненных показателей;
- одевания кислородной маски;
- обработки ожогов;
- искусственной вентиляции легких;
- сердечно-легочной реанимации.
После оказания первой помощи медики транспортируют больного в стационар. В зависимости от его состояния, он может быть госпитализирован в отделение токсикологии, реанимации, офтальмологии, хирургии. При обширных поражениях кожи лечение проводится в ожоговых центрах. Длительность лечения зависит от состояния больного и обширности поражения внутренних органов.
Отравление хлористым водородом – тяжелое и опасное состояние. Его лечение проводится в условиях стационара. Первое, что следует сделать при отравлении, – вызвать скорую помощь. До приезда медиков можно начать самостоятельно помогать ему, обеспечив покой и поступление свежего воздуха, промыть пораженные участки кожи водой.
Соляная кислота (HCl, хлористоводородная кислота, хлористый водород) – бесцветная едкая жидкость со специфическим запахом, одна из самых сильных кислот, способная растворять многие металлы. Получается путем растворения газообразного хлороводорода в воде.
На воздухе соляная кислота дымится, т. к. выделяющийся HCl образует с водяным паром мельчайшие капли, туман.
Хлористый водород, используемый в производстве, имеет желто-зеленый цвет из-за примесей солей железа и хлора. Промышленное применение его очень широко:
- гидрометаллургия драгоценных металлов;
- гальванопластика;
- производство хлористых солей;
- дубление и окрашивание кожи в кожевенной промышленности;
- изготовление клеев, спиртов, кислот;
- фармацевтическое производство;
- текстильная промышленность и т. д.
В концентрации от 0,3 до 0,5% соляная кислота содержится в организме в обычных условиях, являясь основным компонентом желудочного сока. Агрессивные свойства позволяют ей эффективно защищать организм от попавших в ЖКТ вирусов и бактерий. Помимо защитной функции, соляная кислота способствует нормальному процессу пищеварения, стимулирует работу поджелудочной железы, участвует в синтезе гормонов, под ее воздействием происходит дозревание пищеварительных ферментов желудочного сока.
В концентрации от 24 до 38% обладает высокой токсичностью, в связи с чем оборот кислоты подобной насыщенности в РФ ограничен. Особую опасность при работе с концентрированными растворами HCl представляют туманы, образующиеся при ее контакте с воздухом, из-за способности вызывать поражение глаз и дыхательной системы. При попадании на кожу концентрированная кислота вызывает химический ожог.
Смертельная доза при приеме внутрь – 15-20 мл концентрированной кислоты.
Отравление парами и туманами соляной кислоты происходит, как правило, в промышленных и лабораторных условиях и обычно связано с возникновением аварийных ситуаций:
- разгерметизация емкостей с кислотой на производстве;
- нарушение целостности тары при транспортировке;
- коррозия стальной аппаратуры;
- повреждение вентиляционных систем.
В таких случаях особенно опасно находиться с наветренной стороны на нижних этажах зданий, в подвальных помещениях, т. к. пар хлористого водорода тяжелее воздуха и, опускаясь вниз, перемещается движением воздушных масс.
Помимо экстренных ситуаций, причиной отравления могут стать нарушение технологического процесса, пренебрежение средствами индивидуальной защиты и несоблюдение техники безопасности на рабочем месте.
Отравиться соляной кислотой в быту можно в нескольких случаях:
- использование концентрированного раствора для чистки сантехники, утвари, выведения въевшихся пятен;
- приготовление растворов для наружного применения с целью самостоятельного лечения в домашних условиях;
- вдыхание паров при переливании кислоты.
Способы получения, техника безопасности
Получить соляную кислоту можно с помощью растворения газообразного хлороводорода в воде. Хлороводород синтезируют путем взаимодействия водорода с хлором. Кислота, которую получают данным методом, называется синтетической. Другим способом синтеза соляной кислоты является получение соединения из абгазов, которые представляют собой побочные газы, сформированные в разных химических процессах, к примеру, при хлорировании углеводородов. Хлороводород, входящий в состав этих газов, называют абгазным. Полученная рассмотренным методом кислота носит название «абгазная». В последние десятилетия доля абгазной соляной кислоты в объеме производства постепенно увеличивается, вытесняя кислоту, полученную сжиганием водорода в хлоре. С другой стороны, в соляной кислоте, полученной по традиционной технологии в реакции водорода с хлором, содержится меньшее количество примесей. Такую кислоту используют при необходимости высокой чистоты.
Получение хлороводорода в промышленности путем реакции горения водорода в хлоре:
В лабораторных условиях применяют метод получения соляной кислоты, который был разработан еще алхимиками. Он основан на действии концентрированной серной кислоты на поваренную соль:
Нагрев до температуры более 550 °C и наличие избытка поваренной соли являются условиями для протекания химической реакции по уравнению:
Получение соляной кислоты с помощью гидролиза хлоридов магния, алюминия (нагревается гидратированная соль) можно записать с помощью уравнений реакций:
Перечисленные реакции не всегда протекают до конца и сопровождаются образованием основных хлоридов (оксихлоридов) переменного состава, к примеру:
Хлороводород отличается хорошей растворимостью в воде. Например, при 0 °C 1 объем воды способен поглотить 507 объемов HCl. В результате получают концентрированную 45 % кислоту. Следует отметить, что в условиях комнатной температуры характеристика растворимости HCl меньше, поэтому на практике обычно используют 36% соляную кислоту.
Соляную кислоту относят к веществам III класса опасности, согласно ГОСТ 12.1.007-76. Рекомендуемая ПДК в рабочей зоне составляет 5 мгм3. Высококонцентрированная соляная кислота является едким веществом. При контакте соляной кислоты с кожей возникают сильные химические ожоги. С целью нейтрализации ожогов место поражения промывают большим количеством воды, затем обрабатывают 5% раствором соды (она нейтрализует кислоту). Максимально опасно попадание данного вещества в глаза (в значительном количестве).
В процессе открывания резервуаров с концентрированной соляной кислотой можно наблюдать выделение паров хлороводорода, которые, притягивая влагу из воздуха, образуют туман. Газообразное вещество способно раздражать глаза и дыхательные пути человека. Во время реакции с сильными окислителями в виде хлорной извести, диоксида марганца, перманганата калия соляная кислота образует хлор в газообразном состоянии с высокой степенью токсичности. На территории Российской Федерации ограничен оборот соляной кислоты концентрации 15 % и выше.
Использование на производстве
Она имеет широкое применение в металлургической, пищевой и медицинской промышленности.
- Металлургии. Применение при паянии, лужении и зачистке металлов.
- Пищевая промышленность. Применение при производстве пищевых регуляторов кислотности, к примеру, Е507.
- Гальванопластика. Используется при травлении.
- Медицине. Находит свое применение при производстве искусственного желудочного сока.
Входит в состав синтетических красителей. Используется при производстве чистящих и моющих средств. Но в жидкостях, предназначенных для бытового использования, концентрация серной кислоты незначительна.
Первая помощь и методы лечения
При обнаружении признаков отравления требуется вызвать бригаду скорой помощи. В домашних условиях допускается проводить мероприятия, направленные на улучшение состояния пострадавшего. Первая помощь при отравлении соляной кислотой должна проводиться быстро, чтобы уменьшить риск возникновения негативных последствий.
Мероприятия:
- При попадании соляного соединения на кожные покровы места повреждения промывают большим количеством прохладной воды. Длительность обработки составляет не менее получаса.
- При интоксикации парами пострадавшему обеспечивают доступ свежего воздуха, открывают окна, расстегивают тесную одежду.
- Рекомендуется следить за состоянием пациента, при отсутствии признаков жизни проводятся реанимационные действия.
- Пострадавшему от паров разрешается дать выпить теплый чай, воду. Рекомендуется провести полоскание полости носа и рта прохладной водой.
- При передозировке, возникнувшей в результате употребления кислоты внутрь, на живот кладут пузырь со льдом, чтобы исключить либо уменьшить возможное кровотечение.
- Не допускается употребление каких-либо лекарственных средств. Разрешается дать пациенту стакан воды (можно минеральной щелочной). Употреблять жидкость требуется маленькими глотками.
- Не разрешено промывать желудок, пытаться вызвать рвотные позывы в домашних условиях. Подобная первая помощь способна привести к развитию ожогов горла, кровотечению.
Лечение проводится в медицинском учреждении под контролем специалистов.
Терапия:
- Очищение желудка при помощи зонда,
- Использование капельниц с лекарственными растворами,
- Назначение препаратов, снимающих болезненные ощущения,
- Применение медикаментов, направленных на восстановление работы органов и систем,
- При необходимости ингаляции кислородом и искусственная вентиляция легких,
- Проведение реанимационной терапии при отсутствии признаков жизни,
- Подбор витаминов и специального питания.
Лечение проводится в реанимации, а затем в стационаре. Длительность зависит от состояния пациента и степени отравления.
Естественное явление
Многие хлорорганические соединения были выделены из природных источников, от бактерий до людей. Хлорированные органические соединения содержатся почти в каждом классе биомолекул и природных продуктах, включая алкалоиды , терпены , аминокислоты , флавоноиды , стероиды и жирные кислоты . диоксины, которые представляют особую опасность для здоровья человека и окружающей среды, производятся в условиях высоких температур при лесных пожарах, а диоксины были обнаружены в сохранившемся пепле от пожаров, возникших при молнии, которые предшествовали синтетическим диоксинам. Кроме того, из морских водорослей было выделено множество простых хлорированных углеводородов, включая дихлорметан , хлороформ и четыреххлористый углерод . Большая часть хлорметана в окружающей среде образуется естественным путем в результате биологического разложения, лесных пожаров и вулканов.
Природный хлорорганический эпибатидин , алкалоид, выделенный из древесных лягушек, обладает сильным обезболивающим действием и стимулировал исследования новых обезболивающих. Однако из-за неприемлемого терапевтического индекса он больше не является предметом исследований для потенциальных терапевтических применений. Лягушки получают эпибатидин с пищей, который затем попадает в их кожу. Вероятными источниками пищи являются жуки, муравьи, клещи и мухи.
История
Около 900 г. авторы арабских писаний, приписываемые Джабиру ибн Хайяну (латинское: Гебер) и персидскому врачу и алхимику Абу Бакр ар-Рази (ок. 865–925, латинское: Rhazes), экспериментировали с солевым аммиаком ( хлорид аммония ). , который при перегонке вместе с купоросом (гидратированными сульфатами различных металлов) давал хлористый водород. Однако, похоже, что в этих ранних экспериментах с хлоридными солями газообразные продукты были выброшены, а хлористый водород, возможно, производился много раз, прежде чем было обнаружено, что его можно использовать в химии. Одним из первых таких применений был синтез хлорида ртути (II) (коррозионный сублимат), получение которого при нагревании ртути либо с квасцами и хлоридом аммония, либо с купоросом и хлоридом натрия было впервые описано в De aluminibus et salibus (» на квасцов и соли», в eleventh- или двенадцатого века арабский текст ложно приписываемой Абу Бакр аль-Рази и переведен на латинский язык во второй половине двенадцатого века на Жерара Кремона , 1144-1187). Другим важным событием было открытие псевдо-Гебера (в Де inventione Veritatis , «О Discovery Правды», после того, как с. 1300) , что при добавлении хлорида аммония в азотной кислоте , сильный растворитель , способный к растворению золота (т.е., аква regia ) могли быть произведены. После открытия в конце шестнадцатого века процесса, с помощью которого можно получить несмешанную соляную кислоту , было обнаружено, что эта новая кислота (тогда известная как спирт соли или acidum salis ) выделяет парообразный хлористый водород, который назывался морским кислотным воздухом . В 17 веке Иоганн Рудольф Глаубер использовал соль ( хлорид натрия ) и серную кислоту для приготовления сульфата натрия , выделяя газообразный хлористый водород (см. Производство выше). В 1772 году Карл Вильгельм Шееле также сообщил об этой реакции, и иногда ему приписывают ее открытие. Джозеф Пристли получил хлористый водород в 1772 году, а в 1810 году Хэмфри Дэви установил, что он состоит из водорода и хлора .
Во время промышленной революции спрос на щелочные вещества, такие как кальцинированная сода, увеличился, и Николя Леблан разработал новый промышленный процесс производства кальцинированной соды. В процессе Леблана соль превращали в кальцинированную соду с использованием серной кислоты, известняка и угля, получая хлористый водород в качестве побочного продукта. Первоначально этот газ выпускался в воздух, но Закон о щелочах 1863 года запрещал такой выпуск, поэтому производители кальцинированной соды абсорбировали отработанный газ HCl в воде, производя соляную кислоту в промышленных масштабах. Позже был разработан процесс Харгривза , который похож на процесс Леблана, за исключением того , что вместо серной кислоты в реакции, которая в целом является экзотермической, используются диоксид серы , вода и воздух. В начале 20-го века процесс Леблана был фактически заменен процессом Сольве , который не производил HCl. Однако производство хлористого водорода продолжалось как стадия производства соляной кислоты.
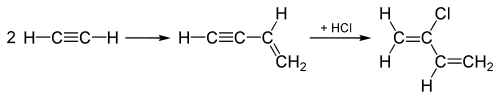
Историческое использование хлористого водорода в 20-м веке включает гидрохлорирование алкинов для получения хлорированных мономеров хлоропрена и винилхлорида , которые впоследствии полимеризуются для получения полихлоропрена ( неопрена ) и поливинилхлорида (ПВХ) соответственно. При производстве винилхлорида ацетилен (C 2 H 2 ) гидрохлорируется путем добавления HCl через тройную связь молекулы C 2 H 2 , превращая тройную связь в двойную связь с образованием винилхлорида.
«Ацетиленовый процесс», использовавшийся до 1960-х годов для производства хлоропрена , начинается с соединения двух молекул ацетилена , а затем добавляется HCl к соединенному промежуточному соединению через тройную связь, чтобы преобразовать его в хлоропрен, как показано здесь:
Этот «ацетиленовый процесс» был заменен процессом, который вместо этого добавляет Cl 2 к двойной связи этилена, а последующее удаление вместо этого дает HCl, а также хлоропрен.
Ссылки [ править ]
- ^ «хлористый водород (CHEBI: 17883)» . Химические объекты, представляющие биологический интерес (ChEBI) . Великобритания: Европейский институт биоинформатики.
- ^ Хейнс, Уильям М. (2010). Справочник по химии и физике (91 изд.). Бока-Ратон, Флорида, США: CRC Press . п. 4–67. ISBN 978-1-43982077-3.
- ^ Хлористый водород . Газовая энциклопедия. Air Liquide
- ^ Типпинг, Э. (2002) . Издательство Кембриджского университета, 2004.
- ^ Trummal, A .; Губа, L .; Кальюранд, I .; Коппель, ИА; Leito, I. «Кислотность сильных кислот в воде и диметилсульфоксиде» J. Phys. Chem. . 2016 , 120 , 3663-3669. DOI : 10.1021 / acs.jpca.6b02253
- ^ a b c Карманный справочник NIOSH по химической опасности. «# 0332» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ a b «Хлороводород» . Немедленно опасные для жизни или здоровья концентрации (IDLH) . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Ouellette, Роберт Дж .; Рон, Дж. Дэвид (2015). Основы органической химии . Elsevier Science. С. 6–. ISBN 978-0-12-802634-2.
- ^ Натта, Г. (1933). «Struttura e polimorfismo degli acidi alogenidrici». Gazzetta Chimica Italiana (на итальянском языке). 63 : 425–439.
- ^ Sándor, E .; Фэрроу, RFC (1967). «Кристаллическая структура твердого хлористого водорода и хлорида дейтерия». Природа . 213 (5072): 171–172. Bibcode1967Natur.213..171S . DOI10.1038 / 213171a0 . S2CID 4161132 .
- ^ Соляная кислота — Резюме соединений . Pubchem
- ^ a b Остин, Северин; Гловацки, Арндт (2000). Соляная кислота . DOI10.1002 / 14356007.a13_283 . ISBN 3527306730.
- ^ Пристли J (1772). «Наблюдения за различными видами воздуха » . Философские труды Лондонского королевского общества . 62 : 147–264 (234–244). DOI10,1098 / rstl.1772.0021 . S2CID 186210131 .
-
^ Дэви Х (1808). «Электрохимические исследования разложения земель; наблюдения за металлами, полученными из щелочноземельных металлов, и амальгамой, полученной из аммиака» . Философские труды Лондонского королевского общества . 98 : 333–370. Bibcode1808RSPT … 98..333D . DOI10.1098 / rstl.1808.0023 .
п. 343: Когда калий нагревали в солянокислом газе , настолько сухом, насколько его можно было получить обычными химическими средствами, происходило сильное химическое воздействие с воспламенением; и когда калий был в достаточном количестве, солянокислый газ полностью исчез, и от одной трети до одной четвертой его объема водорода выделилось, и образовался хлорид калия . (Реакция была: 2HCl + 2K → 2KCl + H 2 )
- ^ Francisco J. Arnsliz (1995). «Удобный способ получения хлористого водорода в лаборатории первокурсника» . J. Chem. Educ. 72 (12): 1139. Bibcode1995JChEd..72.1139A . DOI10.1021 / ed072p1139 .
- ^ Краус, Пауль (1942–1943). Джабир ибн Хайян: Вклад в историю научных идей в исламе. I. Le corpus des écrits jâbiriens. II. Jâbir et la science grecque . Каир: Французский институт археологии Востока . ISBN 9783487091150. OCLC 468740510 .т. II, стр. 41–42; Multhauf, Роберт П. (1966). Истоки химии . Лондон: Олдборн. С. 141-142.
- ^ Multhauf 1966 , стр. 142, примечание 79.
- ^ Multhauf 1966 , стр. 160-163.
- ↑ Карпенко, Владимир; Норрис, Джон А. (2002). «Купорос в истории химии» . Chemické listy . 96 (12): 997–1005.п. 1002.
- ^ Multhauf 1966 , стр. 208, примечание 29; ср. п. 142, примечание 79.
- ^ Хартли, Гарольд (1960). «Лекция Уилкинса. Сэр Хэмфри Дэви, Британская Республика, PRS 1778–1829». Труды Королевского общества А . 255 (1281): 153–180. Bibcode1960RSPSA.255..153H . DOI10,1098 / rspa.1960.0060 . S2CID 176370921 .
- ^ CDC — Карманный справочник NIOSH по химической опасности
- ^ «Хлористый водород» . CDC — Тема безопасности и гигиены труда NIOSH . 5 марта 2012 . Дата обращения 15 июля 2016 .