К вопросу применения водорода на двигателях внутреннего сгорания
Содержание:
- Электролизеры HC12/24V Pro
- Задачи на количество теплоты с решениями
- Безопасность горения
- Применение [ править | править код ]
- Применение [ править | править код ]
- Почему водород — превосходное топливо
- Самовоспламенение — водород
- Реакции водорода с простыми веществами
- Что такое водород
- Механизм процесса горения водорода
- Водородный баланс планеты
- Применение водорода
- Заключение
Электролизеры HC12/24V Pro
1. Рабочее напряжение – 11-14.02 V 2. Ток нагрузки 5 до 30 А 3. Рабочая температура –15 до +50 градусов 4. Потребляемый ток – измеритель уровня: – 5. Концентрация электролита (KOH) – 10 – 14% 6. Производительность Газа Брауна до 2 л/м. 7.Габаритные размеры (mm): H=220 , L=205 , W=175 8. Материал 8.1.Коробка – полипропилен
8.2.Электроды – Сталь 316L
Генератор газа Брауна
Электролизер – устройство в котором электрохимическим путем производится процесс электролиза и в результате выделяется Газ Брауна. Коробка электролизера сделана из полипропилена – материала с хорошей устойчивостью к температурным изменениям, вибрациям, нагрузкам и к агрессивной химической среде. Он имеет форму классического аккумулятора. Состоит из коробки , верхней крышки, штуцеров, клапанов и измерителя уровня. Внутри располагаются электроды, посредством которых осуществляется электролиз. Они сделаны из стали марки 316L . Питание электродов производится через шпильки из нержавеющей стали – А2 (марка 304). При сборке используются шайбы и гайки из нержавеющей стали. Для улучшения электропроводимости вне коробки гайки и шайбы, которыми стягиваются кабельнные вводы для питания электролизера – из обычной стали – оцинкованной. Электролизер облеплен стикерами которые указывают предназначение отверстий и штуцеров. Клеммы питания обозначены плюсом и минусом и непосредственно отпечатаны на пластмассе коробки. На электролизере имеется и информационная наклейка с названием изделия и информацией и координатах производителя. Надписи – на болгарском и английском языках.
Контакты – Заказ …
Прайс лист …
Задачи на количество теплоты с решениями
Формулы, используемые на уроках «Задачи на количество теплоты,
удельную теплоемкость».
1 г = 0,001 кг; 1 т = 1000 кг; 1 кДж = 1000 Дж; 1 МДж = 1000000 Дж
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задача № 1.
В железный котёл массой 5 кг налита вода массой 10 кг. Какое количество теплоты нужно передать котлу с водой для изменения их температуры от 10 до 100 °С?
При решении задачи нужно учесть, что оба тела — и котёл, и вода — будут нагреваться вместе. Между ними происходит теплообмен. Их температуры можно считать одинаковыми, т. е. температура котла и воды изменяется на 100 °С — 10 °С = 90 °С. Но количества теплоты, полученные котлом и водой, не будут одинаковыми. Ведь их массы и удельные теплоёмкости различны.
Задача № 2.
Смешали воду массой 0,8 кг, имеющую температуру 25 °С, и воду при температуре 100 °С массой 0,2 кг. Температуру полученной смеси измерили, и она оказалась равной 40 °С. Вычислите, какое количество теплоты отдала горячая вода при остывании и получила холодная вода при нагревании. Сравните эти количества теплоты.
Задача № 3.
Стальная деталь массой 3 кг нагрелась от 25 до 45 °С. Какое количество теплоты было израсходовано?
Задача № 4.
В сосуде содержится 3 л воды при температуре 20 °С. Сколько воды при температуре 45 °С надо добавить в сосуд, чтобы в нём установилась температура 30 °С? Необходимый свободный объём в сосуде имеется. Теплообменом с окружающей средой пренебречь
Задача № 5.
На сколько градусов изменилась температура чугунной детали массой 12 кг, если при остывании она отдала 648000 Дж теплоты?
Задача № 6.
По графику определите удельную теплоёмкость образца, если его масса 50 г.
Задача № 7.
Для нагревания медного бруска массой 3 кг от 20 до 30 °С потребовалось 12000 Дж теплоты. Какова удельная теплоемкость меди?
Задача № 8.
Нагретый камень массой 5 кг, охлаждаясь в воде на 1 °С, передает ей 2,1 кДж энергии. Чему равна удельная теплоемкость камня?
Задача № 9.
Какое количество теплоты потребуется для нагревания на 1 °С воды объемом 0,5 л; олова массой 500 г; серебра объемом 2 см3; стали объемом 0,5 м3; латуни массой 0,2 т?
Задача № 10.
Какое количество теплоты получили алюминиевая кастрюля массой 200 г и находящаяся в ней вода объемом 1,5 л при нагревании от 20 °С до кипения при температуре 100 °С?
Задача № 11.
а) Воздух, заполняющий объем 0,5 л в цилиндре с легким поршнем, нагрели от 0 до 30 °С при постоянном атмосферном давлении. Какое количество теплоты получил воздух? б) В порожнем закрытом металлическом баке вместимостью 60 м3 под действием солнечного излучения воздух нагрелся от 0 до 20 °С. Как и на сколько изменилась внутренняя энергия воздуха в баке? (Удельная теплоемкость воздуха при постоянном объеме равна 720 Дж/кг-°С.)
Задача № 12.
ОГЭ
Металлический цилиндр массой m = 60 г нагрели в кипятке до температуры t = 100 °С и опустили в воду, масса которой mв = 300 г, а температура tв = 24 °С. Температура воды и цилиндра стала равной Θ = 27 °С. Найти удельную теплоёмкость металла, из которого изготовлен цилиндр. Удельная теплоёмкость воды св = 4200 Дж/(кг К).
Задача № 13.
В теплоизолированном сосуде сначала смешивают три порции воды 100 г, 200 г и 300 г с начальными температурами 20 °C, 70 °C и 50 °C соответственно. После установления теплового равновесия в сосуд добавляют новую порцию воды массой 400 г при температуре 20 °C. Определите конечную температуру в сосуде. Ответ дайте в °C, округлив до целого числа. Теплоёмкостью калориметра пренебрегите.
Решение.
Ответ: 39 °С.
Задача № 14. (повышенной сложности)
Стальной шарик радиусом 5 см, нагретый до температуры 500 ˚С, положили на лед, температура которого 0 ˚С. На какую глубину погрузится шарик в лед? (Считать, что шарик погрузился в лед полностью. Теплопроводностью шарика и нагреванием воды пренебречь.)
Дано: R = 0,05 м; t1 = 500 ˚С; t2 = 0 ˚С;
ρ1 (плотность стали) = 7800 кг/м3.;
ρ2 (плотность льда) = 900 кг/м3.
c (удельная теплоемкость стали) = 460 Дж/кг •˚С,
λ (удельная теплота плавления льда) = 3,3 • 105 Дж/кг,
Найти: h – ?
Конспект урока «Задачи на количество теплоты».
Посмотреть конспект урока по теме «Количество теплоты. Удельная теплоемкость»
Следующая тема: «ЗАДАЧИ на сгорание топлива с решениями».
Безопасность горения
Это важная характеристика воспламеняющейся смеси, поскольку она позволяет судить о том, происходит реакция спокойно, и можно ее контролировать, либо процесс имеет взрывной характер. От чего зависит скорость горения? Конечно же, от концентрации реагентов, от давления, а также от количества энергии «затравки».
К большому сожалению, водород в широком интервале концентраций способен к взрывному горению. В литературе приводятся следующие цифры: 18,5-59 % водорода в воздушной смеси. Причем на краях этого предела в результате детонации выделяется наибольшее количество энергии на единицу объема.
Отмеченный характер горения представляет большую проблему для использования этой реакции в качестве контролируемого источника энергии.
Применение [ править | править код ]
В XIX веке для освещения в театрах использовался так называемый друммондов свет, где свечение получалось с помощью пламени кислород-водородной смеси, направленного непосредственно на цилиндр из негашёной извести, которая может нагреваться до высоких температур (белого каления) без расплавления. В пламени кислород-водородной смеси достигается высокая температура, и также в XIX веке это нашло применение в паяльных лампах для плавления тугоплавких материалов, резки и сварки металлов. Однако все эти попытки применения гремучего газа были ограничены тем, что он очень опасен в обращении, и были найдены более безопасные варианты решения этих задач.
В настоящее время водород считается перспективным топливом для водородной энергетики. При горении водорода образуется чистая вода, поэтому этот процесс считается экологически чистым. Основные проблемы связаны с тем, что затраты на производство, хранение и транспортировку водорода к месту его непосредственного применения слишком высоки, и при учёте всей совокупности факторов водород пока не может конкурировать с традиционными углеводородными топливами.
Применение [ править | править код ]
В XIX веке для освещения в театрах использовался так называемый друммондов свет, где свечение получалось с помощью пламени кислород-водородной смеси, направленного непосредственно на цилиндр из негашёной извести, которая может нагреваться до высоких температур (белого каления) без расплавления. В пламени кислород-водородной смеси достигается высокая температура, и также в XIX веке это нашло применение в паяльных лампах для плавления тугоплавких материалов, резки и сварки металлов. Однако все эти попытки применения гремучего газа были ограничены тем, что он очень опасен в обращении, и были найдены более безопасные варианты решения этих задач.
В настоящее время водород считается перспективным топливом для водородной энергетики. При горении водорода образуется чистая вода, поэтому этот процесс считается экологически чистым. Основные проблемы связаны с тем, что затраты на производство, хранение и транспортировку водорода к месту его непосредственного применения слишком высоки, и при учёте всей совокупности факторов водород пока не может конкурировать с традиционными углеводородными топливами.
Почему водород — превосходное топливо
Водород — первый химический элемент в таблице Менделеева. Это газ с самой маленькой молярной массой — он легче воздуха в 14,5 раз. Обладает очень высоким коэффициентом диффузии, то есть отлично смешивается с любыми другими газами.
Это самый распространенный элемент во всей нашей Вселенной. В связанном состоянии водород находится в составе молекулы воды, так что на Земле с его доступностью также нет никаких проблем.
Как человек с образованием инженера-автомеханика по специальности «двигатель внутреннего сгорания», я считаю, что водород — уникальное топливо для автомобильного двигателя. От других видов топлива его отличают:
-
Самая высокая теплота сгорания. При сжигании одного килограмма бензина мы можем получить 45 МДж теплоты, а при сжигании такого же количества водорода — почти в три раза больше, 120 МДж теплоты. И это низшая теплота сгорания водорода.
-
Широкие пределы воспламенения. Можно воспламенить как очень бедную топливо-воздушную смесь, в которой по массе мало водорода, так и очень богатую. Предел воспламенения смеси водорода с воздухом — от 0,2 до 10 единиц. Для сравнения: у бензовоздушной смеси коэффициент избытка воздуха должен быть в диапазоне 0,7–1,2.
-
Самая высокая скорость сгорания. Этот параметр очень важен с точки зрения достижения необходимых характеристик автомобильного двигателя, в частности эффективной работы в цикле. В одном и том же двигателе скорость сгорания водорода будет примерно в три раза выше, чем скорость сгорания бензовоздушной смеси.
Самовоспламенение — водород
Самовоспламенение водорода при истечении из трубопроводов и аппаратов, находящихся под высоким давлением, часто является причиной аварии. Однако эта опасность не всегда учитывается производственниками.
Самовоспламенение водорода при истечении из трубопроводов и аппаратов, находящихся под высоким давлением, часто является-причиной аварии. Однако эта опасность не всегда учитывается производственниками.
Температура самовоспламенения водорода довольно высока, но энергия воспламенения крайне незначительна — лишь 20 кДж, что составляет менее 7 % аналогичного показателя для природного газа. Поэтому водород можно применять в каталитических генераторах теплоты, в которых он горит бесцветным пламенем при низких температурах ( около 200 С), не загрязняя воздуха. Окислов азота не образуется; единственный побочный продукт — вода, которую можно использовать для увлажнения воздуха в помещениях. С помощью катализаторов можно сжигать газовые смеси, содержащие не более 4 % водорода. Благодаря этому обеспечивается полное его сгорание. При наличии соответствующих теплоприемников можно добиться почти 100 % — ного использования выделяющейся теплоты, поскольку отсутствуют ее потери с дымовыми газами.
Температура самовоспламенения водорода в смеси с углеводородами снижается до 400 С, что обуславливает особые требования к контролю за герметичностью системы и предотвращению загазованности.
Для предотвращения самовоспламенения водорода и образования взрывоопасных воздушно-водородных и паро-водородных смесей применяются специальные дожигатели водорода внутри защитной оболочки реактора, а также устройства сдувки парогазовой смеси из свободного пространства реактора с последующим дожиганием.
При небольших частицах натрия эта реакция сопровождается самовоспламенением водорода. При попадании в воду крупных частиц происходит взрыв. Взрывом могут сопровождаться также реакции взаимодействия натрия с бромистым этилом и хлористым этилом; с кислотами и водяными растворами различных веществ. При 700 — 900 С натрий реагирует с углекислотой. Нагретый натрий самовоспламеняется на воздухе.
Водород в смеси с кислородом образует гремучую смесь. Температура самовоспламенения водорода в Смеси с углеводородами снижается до 400 — 450 С, чем и объясняется возгорание горячих газов при пропусках в соединениях. Кроме того, пожарная опасность усиливается наличием в топках печей открытого огня, аппаратов и трубопроводов с температурой стенок до 530 С при высоком давлении, что обусловливает особые требования к контролю за герметичностью системы, предотвращению загазованности.
Кусочки натрия под действием выделяющейся теплоты реакции ( для реакции с твердым натрием ДЯ — 368 кДж) расплавляются в шарики, которые начинают беспорядочно двигаться по поверхности воды вследствие выделения водорода. Над отдельными участками поверхности происходит самовоспламенение водорода или местные взрывы гремучего газа ( характерные щелчки), особенно если шарик жидкого натрия прилипает к стенке сосуда и сильно разогревается
При этом возможно разбрызгивание раствора образующейся щелочи ( при работе с натрием необходимо соблюдать осторожность, глаза следует защищать предохранительными очками.
Увеличение активности молекулярного водорода при интенсивном освещении, воздействии электрической искры или шероховатых металлических поверхностей может привести к взрыву смесей водорода с кислородом, в том числе с кислородом воздуха. В, обычном состоянии водород загорается лишь при интенсивном нагревании струи газа или поджигании, так как температура самовоспламенения водорода высока — 510 С. Но при контакте во-дородо-воздушных или водородо-кислородных смесей с поверхностью железа, никеля или некоторых других металлов достаточно лишь незначительного местного нагревания газовой смеси, чтобы произошел взрыв.
В атмосфере хлора и фтора щелочные металлы самовоспламеняются. С жидким бромом литий и натрий реагируют замедленно, остальные металлы — бурно, со взрывом. С иодом взаимодействие протекает менее энергично. Литий с водой взаимодействует спокойно, для натрия наблюдается значительный тепловой эффект, но выделяющийся водород обычно не воспламеняется. У калия взаимодействие с водой сопровождается самовоспламенением водорода, рубидий и цезий реагируют с водой со взрывом, вытесняют водород из воды ( льда) даже при — 108 С.
Реакции водорода с простыми веществами
При нагревании водород вступает в реакции соединения с простыми веществами — кислородом, хлором, азотом, серой.
Если поджечь на воздухе чистый водород, выходящий из газоотводной трубки, он горит ровным, еле заметным пламенем. Теперь поместим трубку с горящим водородом в банку с кислородом (рис. 95).
Горение водорода продолжается, при этом на стенках банки видны капли воды, образующейся в результате реакции:
При горении водорода выделяется много теплоты. Температура кислородно-водородного пламени достигает больше 2000 °С.
Химическая реакция водорода с кислородом относится к реакциям соединения. В результате реакции образуется оксид водорода (вода). Это значит, что произошло окисление водорода кислородом, т. е. эту реакцию мы можем назвать и реакцией окисления.
Если же в пробирку, опрокинутую вверх дном, собрать немного водорода методом вытеснения воздуха, а затем поднести к ее отверстию горящую спичку, то раздастся громкий «лающий» звук небольшого взрыва смеси водорода с воздухом. Такую смесь называют «гремучей».
Способность водорода в смеси с воздухом образовывать «гремучий газ» часто являлась причиной катастроф на воздушных шарах, заполненных водородом. Нарушение герметичности оболочки шара приводило к пожару и даже взрыву. В наше время воздушные шары заполняют гелием или постоянно нагнетаемым горячим воздухом.
В атмосфере хлора водород сгорает с образованием сложного вещества — хлороводорода. При этом протекает реакция:
Реакция водорода с азотом происходит при повышенной температуре и давлении в присутствии катализатора. В результате реакции образуется аммиак NH3:
Если струю водорода направить на расплавленную в пробирке серу, то у ее отверстия ощутится запах тухлых яиц. Так пахнет газ сероводород H2S — продукт реакции водорода с серой:
Водород способен не только растворяться в некоторых металлах, но и реагировать с ними. При этом образуются химические соединения, называемые гидридами (NaH — гидрид натрия). Гидриды некоторых металлов используют как горючее в ракетных двигателях на твердом топливе, а также при получении термоядерной энергии.
Что такое водород
Его атомный номер — единица. На одноатомную форму водорода приходится около 75% барионной массы, она считается самым распространенным веществом во всей Вселенной. Водородная плазма — основное вещество звезд, за исключением компактных.
У водорода три изотопа:
- протий (1H);
- дейтерий (2H);
- тритий (3H).
К общим характеристикам относятся следующие свойства: не имеет цвета запаха, вкуса. Двухатомная форма (Н2) нетоксична, однако в соединении с воздухом (или О2) пожароопасна и склонна к взрывам. Взрывоопасность также проявляется в присутствии прочих газов-окислителей, например, фтора, хлора.
На Земле водород присутствует в составе молекулярных соединений, например, вода. Его роль в кислотно-основных реакциях трудно переоценить.
Механизм процесса горения водорода
Описанная в предыдущем пункте химическая реакция известна любому школьнику старших классов, однако она является очень грубым описанием того процесса, который происходит в действительности. Отметим, что до середины прошлого века человечество не знало, как происходит горение водорода в воздухе, а в 1956 году за ее изучение была присуждена Нобелевская премия по химии.
В действительности, если столкнуть молекулы O2 и H2, то никакой реакции не произойдет. Обе молекулы являются достаточно устойчивыми. Чтобы горение происходило, и образовывалась вода, необходимо существование свободных радикалов. В частности, атомов H, O и групп OH. Ниже приводится последовательность реакций, которые происходят в действительности при горении водорода:
- H + O2 => OH + O;
- OH + H2 => H2O + H;
- O + H2 = OH + H.
Что видно из этих реакций? При горении водорода образуется вода, да, верно, но происходит это только, когда группа из двух атомов OH встречается с молекулой H2. Кроме того, все реакции происходят с образованием свободных радикалов, это означает, что запускается процесс самоподдержания горения.
Таким образом, ключевой момент в запуске этой реакции заключается в образовании радикалов. Они появляются, если поднести к кислород-водородной смеси горящую спичку, либо если нагреть эту смесь выше определенной температуры.
Водородный баланс планеты
В Земной атмосфере находится около 2.5 млрд. тонн водорода, который улетучивается в космос по 250 тысяч тонн в год. Источником восполнения «космических потерь» является водородная дегазация Земли в различных проявлениях.
Водородная дегазация планеты — явление выделения водорода в смеси с другими флюидными газами (чаще всего углеводородами, гелием и радоном) в рифтовых зонах, при извержениях вулканов, из разломов земной коры, кимберлитовых трубок, некоторых шахт, и скважин. Во многих случаях землетрясения тектонического происхождения сопровождаются увеличением содержания водорода в воздухе на территории эпицентра и прилегающих площадях.

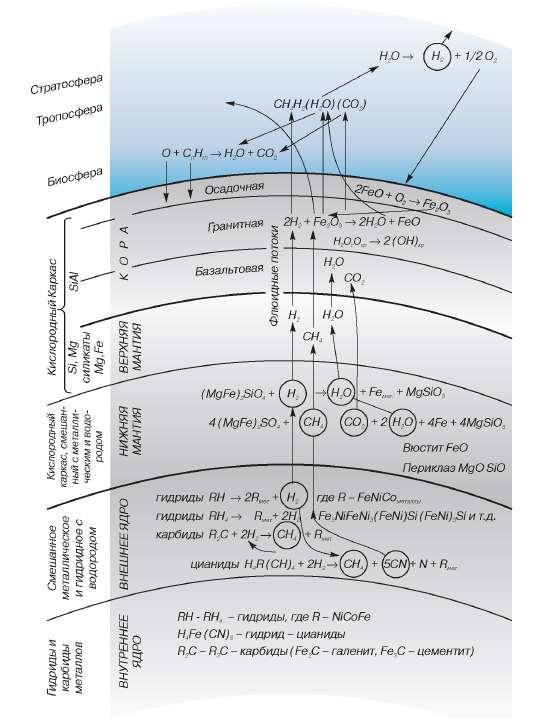 Геохимическая модель Земли
Геохимическая модель Земли
Как видно из схемы водородной дегазации, до поверхности Земли глубинный водород доходит в виде углеводородов, воды и в виде газа Н2. В общий водородный баланс добавляют и реакции гидролиза океанической воды при амфиболизации, хлоритизации, серпентинизации пород мантии в зонах субдукции по преобладающей схеме:
2Mg2SiO4(оливин) + 22H2O = 3Mg6{Si4O10}(OH)8(серпентин) + 6Mg(OH)2(брусит) + 4H2.
Литосфера, как плотный слой оксидов, является сложнопреодолимым барьером, препятствующим выходу водорода на поверхность. В результате происходит накопление газа под корой, где он вступает в химические реакции с прочими веществами, что сопровождается дополнительным выделением тепла. Скорее всего, именно наличие водорода делает астеносферу квази-жидкой средой. Полученные методом сейсмотомографии данные свидетельствуют о том, что на глубине около 100 км над астеносферой формируются многочисленные очаги землетрясений, фиксирующие подъем флюидного и расплавного материала.
Применение водорода
Основными направлениями применения водорода являются:
- химическая промышленность – синтез аммиака, метанола, углеводородов;
- пищевая промышленность – получение пищевых белков;
- нефтехимия – нефтепереработка (гидрогенезационная очистка нефтепродуктов);
- автотранспорт – автомобили на газообразном и жидком водороде;
- машиностроение – для сварки и резки металлов.
Применение водорода в сварке
Водород использовался в качестве защитного газа еще при первых попытках защиты дугового пространства от воздуха. Однако водород может оказать в ряде случаев вредное воздействие. Это объясняется тем, что при применении водорода в металле сварных швов образуются дефекты в виде пор, а также является одним из главных факторов образования холодных трещин. С увеличением толщины свариваемых элементов пористость в металле сварных швов становится значительной. Поэтому его использование в дальнейшем было значительно ограничено. В чистом виде (и в виде водородно-азотных смесей, получаемых при диссоциации аммиака) он в настоящее время применяется при атомно-водородной сварке (хотя и сам этот способ заменен теперь другими, в частности сваркой неплавящимся электродом).
Если струю водорода пропускать через пламя вольтовой дуги, то водород диссоциирует на атомы с поглощением значительного количество тепла (103,6 ккал/моль) что приводит к значительному увеличению напряжения дуги. Она становится устойчивой только при повышении напряжения источника тока. Так, например, при режимах атомно-водородной сварки наиболее эффективной «звенящей» дугой при вольфрамовых электродах и силе тока 10-20 А напряжение дуги составляет около 100 А, напряжение холостого хода питающего источника должно быть не менее 200-220 В (обычно около 300 В). В этом случае водород является не только защитным газом, но и переносит тепловую энергию из дуги на поверхность не включенного в цепь тока изделия.
Образовавшийся атомный водород направляют на твердую свариваемую поверхность, где происходит нагревание и расплавление металла за счет поглощения тепла, которое выделяется при рекомбинации атомов до молекулярного водорода. Ассоциация атомарного водорода на холодной поверхности металла (в том числе и расплавленной, так как температура плавления большинства металлов ниже температуры возможного существования заметных количеств атомарного водорода) приводит к выделению тепла, потребленного в дуге на диссоциацию. За счет выделяющегося тепла температура свариваемой поверхности металла повышается до 3528-4028°С. Такая атомно-водородная сварка позволяет обрабатывать и сваривать самые тугоплавкие металлы, высококачественные стали, коррозионно-устойчивые материалы, цветные металлы.
Несмотря на то, что атмосфера, окружающая металл, при атомно-водородной сварке представляет собой смесь молекулярного и атомарного водорода, при отсутствии на металле значительного количества окислов швы получаются достаточно плотными и применительно к низкоуглеродистой стали не имеют большого количества диффузионно-подвижного и остаточного водорода.
При струйной защите иногда используется водяной пар. Однако в этом случае получается значительно меньшая стабильность качества сварных швов, чем при сварке с защитой дуги углекислым газом. В связи с этим такой процесс широкого распространения не получил.
При TIG сварке аустенитной нержавеющей стали с целью увеличения напряжения дуги, увеличения теплоэффективности и снижения оксидирования используют аргоно-водородные смеси газов (15% Н2). Более высокая температуру и сжатие дуги, в свою очередь увеличивает глубину проплавления металла. Однако при этом необходимо учитывать возможность вредного влияния растворяющегося в металле водорода. Более широко водород применяют в специальных областях сварки и металлургии, например в порошковой металлургии при спекании изделий из порошковых материалов.
В других случаях применение водорода и водородосодержащих газов, как защитных при дуговой сварке, нецелесообразно.
Применяют водород для составления плазмообразующих смесей при плазменной сварке и резке. Так, для защиты сварочной ванны от окисления при плазменной сварке легированной стали, меди, никеля и сплавов на его основе используют смесь аргона с 5-8% водорода.
Аргоно-водородную смесь, имеющую до 20% Н2, применяют при микроплазменной сварке. Наличие водорода в смеси обеспечивает сжатие столба плазмы, делает его более сконцентрированным. Кроме того, водород создает необходимую в ряде случаев восстановительную атмосферу.
Заключение
На данный момент не существует недорогого и одновременно высокоэффективного оборудования для получения газа Брауна из воды. Пока первенство в отоплении остается за углеводородами, но технологии продолжают совершенствоваться и не исключено, что скоро водородные генераторы станут достойно конкурировать с традиционными источниками тепловой энергии.
Грем у чий газ, смесь двух объёмов водорода и одного объёма кислорода. При поджигании гремучий газ сильно взрывается, в присутствии губчатой платины горит спокойнее; реакция 2H2+O2=2H2O+ +572,5 кдж (136,74 ккал) позволяет получать высокие температуры (около 2800°C). Поэтому пламя гремучего газа служит для плавки кварца, платины и др., а также газовой сварки и резки металлов.



