Сернистый ангидрид
Содержание:
- Содержание:
- Как загрязнитель воздуха
- Детальный разбор высшего оксида
- Подготовка
- Химические свойства серной кислоты:
- Химические свойства[ | код]
- Сероводород
- Физические свойства
- Приложения
- Ссылки
- Свойства ангидридов
- Особые свойства концентрированной H2SO4 :
- Структура SO 3
- Литература
- Органические ангидриды
- Способы получения и как применяется
Содержание:
В ангидриды Это химические соединения, которые образуются в результате объединения двух молекул посредством выделения воды.Таким образом, это можно рассматривать как обезвоживание исходных веществ; хотя это не совсем так.
Они упоминаются в органической и неорганической химии, и в обеих отраслях их понимание значительно различается. Например, в неорганической химии основные и кислотные оксиды рассматриваются как ангидриды их гидроксидов и кислот соответственно, поскольку первые реагируют с водой с образованием вторых.

Здесь может возникнуть путаница между терминами «безводный» и «ангидрид». Как правило, безводный относится к соединению, до которого оно было дегидратировано без изменений в его химической природе (нет реакции); в то время как с ангидридом происходит химическое изменение, отражающееся в молекулярной структуре.
Если гидроксиды и кислоты сравнить с их соответствующими оксидами (или ангидридами), будет видно, что реакция произошла. С другой стороны, некоторые оксиды или соли могут гидратироваться, терять воду и оставаться такими же соединениями; но без воды, то есть безводный.
С другой стороны, в органической химии ангидрид является первоначальным определением. Например, одними из самых известных ангидридов являются ангидриды, полученные из карбоновых кислот (верхнее изображение). Они состоят из объединения двух ацильных групп (-RCO) через атом кислорода.
В его общей структуре обозначено R1 для ацильной группы и R2 для второй ацильной группы. Потому что R1 и R2 они разные, они происходят из разных карбоновых кислот, и тогда это ангидрид асимметричной кислоты. Когда оба заместителя R (независимо от того, являются ли они ароматическими) одинаковы, в данном случае он упоминается как симметричный ангидрид кислоты.
Когда две карбоновые кислоты связываются с образованием ангидрида, вода может образовываться, а может и не образовываться, а также другие соединения. Все будет зависеть от состава этих кислот.
Как загрязнитель воздуха
Сборник оценок прошлых и будущих антропогенных глобальных выбросов диоксида серы. Cofala et al. оценки предназначены для исследований чувствительности к политике выбросов SO 2 , CLE: текущее законодательство, MFR: максимально возможные сокращения. RCP (репрезентативные траектории концентрации) используются в симуляциях CMIP5 для последнего (2013–2014 гг.) 5-го оценочного отчета МГЭИК.
Диоксид серы является заметным компонентом атмосферы, особенно после извержений вулканов. По данным Агентства по охране окружающей среды США , количество двуокиси серы, выбрасываемой в США в год, составило:
| Год | SO 2 |
|---|---|
| 1970 г. | 31 161 000 коротких тонн (28,3 млн т) |
| 1980 г. | 25 905 000 коротких тонн (23,5 млн т) |
| 1990 г. | 23 678 000 коротких тонн (21,5 млн т) |
| 1996 г. | 18 859 000 коротких тонн (17,1 млн т) |
| 1997 г. | 19 363 000 коротких тонн (17,6 млн т) |
| 1998 г. | 19 491 000 коротких тонн (17,7 млн т) |
| 1999 г. | 18 867 000 коротких тонн (17,1 млн т) |
Диоксид серы является одним из основных загрязнителей воздуха и оказывает значительное влияние на здоровье человека. Кроме того, концентрация диоксида серы в атмосфере может влиять на пригодность среды обитания для растительных сообществ, а также жизни животных. Выбросы диоксида серы являются предвестником кислотных дождей и атмосферных твердых частиц. Во многом благодаря Программе кислотных дождей Агентства по охране окружающей среды США , в США произошло снижение выбросов на 33% в период с 1983 по 2002 год. Это улучшение было частично результатом десульфуризации дымовых газов — технологии, которая позволяет химически связывать SO 2 при сжигании на электростанциях. серосодержащий уголь или нефть . В частности, оксид кальция (известь) реагирует с диоксидом серы с образованием сульфита кальция
- CaO + SO 2 → CaSO 3
Аэробное окисление CaSO 3 дает CaSO 4 , ангидрит . Большая часть гипса, продаваемого в Европе, производится десульфуризацией дымовых газов.
Для контроля выбросов серы были разработаны десятки методов с относительно высокой эффективностью для оснащения угольных электростанций.
Серу можно удалить из угля во время сжигания, используя известняк в качестве материала слоя при сжигании в псевдоожиженном слое .
Серу также можно удалить из топлива перед сжиганием, предотвращая образование SO 2 при сжигании топлива. Процесс Клауса используется на нефтеперерабатывающих заводах для производства серы в качестве побочного продукта. Процесс Стрэтфорда был также использован для удаления серы из топлива. Также можно использовать окислительно-восстановительные процессы с использованием оксидов железа, например, Lo-Cat или Sulferox.
Анализ показал, что 18 угольных электростанций на западных Балканах выбрасывают в два с половиной раза больше диоксида серы, чем все 221 угольная электростанция в ЕС вместе взятые.
Присадки к топливу, такие как добавки кальция и карбоксилат магния, могут использоваться в судовых двигателях для снижения выбросов двуокиси серы в атмосферу.
По состоянию на 2006 год Китай был крупнейшим в мире загрязнителем диоксида серы: в 2005 году выбросы оценивались в 25 490 000 коротких тонн (23,1 Мт). Это количество на 27% больше, чем в 2000 году, и примерно сопоставимо с выбросами в США в 1980 году.
Детальный разбор высшего оксида
При окислении SO2 воздухом под воздействием высоких температур, необходимым условием является наличие катализатора, например V2O5, Fe2O3, NaVO3 или Pt.
Термическое разложение сульфатов либо взаимодействие озона и SO2:
- Fe2(SO4)3 = Fe2O3+3SO3;
- SO2+O3 = SO3+O2.
Окисление SO2 при помощи NO2:
SO2+NO2 = SO3+NO.
К физическим качественным характеристикам относятся: наличие в состоянии газа плоского строения, тригонального типа и D3h симметрии, во время перехода от газа к кристаллу или жидкости образует тример циклического характера и зигзагообразную цепь, имеет ковалентную полярную связь.
В твердой форме SO3 встречается в альфа, бета, гамма и сигма формах, при этом он имеет, соответственно, разную температуру плавления, степень проявления полимеризации и разнообразную кристаллическую форму. Существование такого количества видов SO3 обусловлено образованием связей донорно-акцепторного типа.
К свойствам ангидрида серы можно отнести множество его качеств, основными из них являются:
Способность взаимодействовать с основаниями и оксидами:
- 2KHO+SO3 = K2SO4+H2O;
- CaO+SO3 = CaSO4.
Высший серный оксид SO3 имеет достаточно большую активность и создает серную кислоту, взаимодействуя с водой:
SO3+H2O = H2SO4.
Вступает в реакции взаимодействия с хлороводородом и образует хлоросульфатную кислоту:
SO3+HCl = HSO3Cl.
Для оксида серы характерным является проявление сильных окислительных свойств.
Применение серный ангидрид находит в создании серной кислоты. Небольшое его количество выделяется в окружающую среду во время использования серных шашек. SO3, образуя серную кислоту после взаимодействия с влажной поверхностью, уничтожает разнообразные опасные организмы, например грибки.
Подготовка
Прямое окисление диоксида серы до триоксида серы на воздухе происходит очень медленно:
- SO 2 + 1 ⁄ 2 O 2 = SO 3 ΔH = -198,4
Промышленные
Промышленно SO 3 производится контактным способом . Диоксид серы получают путем сжигания серы или железного пирита (сульфидной руды железа). После очистки электростатическим осаждением SO 2 затем окисляется кислородом воздуха при температуре от 400 до 600 ° C над катализатором. Типичный катализатор состоит из пятиокиси ванадия (V 2 O 5 ), активированной оксидом калия K 2 O на подложке из кизельгура или диоксида кремния . Платина также работает очень хорошо, но она слишком дорога и гораздо легче отравляется (становится неэффективной) примесями. Большая часть полученного таким образом триоксида серы превращается в серную кислоту .
Лаборатория
Серы триоксид могут быть получены в лаборатории путем двухстадийного пиролиза из бисульфата натрия . Пиросульфат натрия — промежуточный продукт:
- Обезвоживание при 315 ° C:
- 2 NaHSO 4 → Na 2 S 2 O 7 + H 2 O
- Растрескивание при 460 ° C:
- Na 2 S 2 O 7 → Na 2 SO 4 + SO 3
Напротив, KHSO 4 не подвергается такой реакции.
Он также может быть получен дегидратацией серной кислоты с фосфорным ангидридом .
Химические свойства серной кислоты:
H2SO4 – сильная двухосновная кислота, одна из самых сильных минеральных кислот, из-за высокой полярности связь Н – О легко разрывается.
1) В водном растворе серная кислота диссоциирует, образуя ион водорода и кислотный остаток:
H2SO4 = H+ + HSO4–;
HSO4– = H+ + SO42-.
Суммарное уравнение:
H2SO4 = 2H+ + SO42-.
2) Взаимодействие серной кислоты с металлами:
Разбавленная серная кислота растворяет только металлы, стоящие в ряду напряжений левее водорода:
Zn + H2+1SO4(разб) → Zn+2SO4 + H2
3) Взаимодействие серной кислоты с основными оксидами:
CuO + H2SO4 → CuSO4 + H2O
4) Взаимодействие серной кислоты с гидроксидами:
H2SO4 + 2NaOH → Na2SO4 + 2H2O
H2SO4 + Cu(OH)2 → CuSO4 + 2H2O
5) Обменные реакции с солями:
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
Образование белого осадка BaSO4 (нерастворимого в кислотах) используется для обнаружения серной кислоты и растворимых сульфатов (качественная реакция на сульфат ион).
Химические свойства[ | код]
SO3 — типичный кислотный оксид, ангидрид серной кислоты. Его химическая активность достаточно велика.
При взаимодействии с водой образует серную кислоту:
-
- SO3+H2O→H2SO4{\displaystyle {\mathsf {SO_{3}+H_{2}O\rightarrow H_{2}SO_{4}}}}
Однако в данной реакции серная кислота образуется в виде аэрозоля, и поэтому в промышленности оксид серы(VI) растворяют в серной кислоте с образованием олеума, который далее растворяют в воде до образования серной кислоты нужной концентрации.
Взаимодействует с основаниями:
-
- 2KOH+SO3→K2SO4+H2O{\displaystyle {\mathsf {2KOH+SO_{3}\rightarrow K_{2}SO_{4}+H_{2}O}}}
А также с оксидами:
-
- CaO+SO3→CaSO4{\displaystyle {\mathsf {CaO+SO_{3}\rightarrow CaSO_{4}}}}
SO3 характеризуется сильными окислительными свойствами, обычно восстанавливается до диоксида серы:
-
- 5SO3+2P→P2O5+5SO2↑{\displaystyle {\mathsf {5SO_{3}+2P\rightarrow P_{2}O_{5}+5SO_{2}\uparrow }}}
-
- 3SO3+H2S→4SO2↑+H2O{\displaystyle {\mathsf {3SO_{3}+H_{2}S\rightarrow 4SO_{2}\uparrow +H_{2}O}}}
-
- 2SO3+2KI→SO2↑+I2+K2SO4{\displaystyle {\mathsf {2SO_{3}+2KI\rightarrow SO_{2}\uparrow +I_{2}+K_{2}SO_{4}}}}
При взаимодействии с хлороводородом образуется хлорсульфоновая кислота, образуя тионилхлорид:
-
- SO3+Cl2+2SCl2→3SOCl2{\displaystyle {\mathsf {SO_{3}+Cl_{2}+2SCl_{2}\rightarrow 3SOCl_{2}}}}
Сероводород
H2S — сероводород, сильно ядовитый газ с противным запахом тухлых яиц. Правильнее сказать, белки яиц при гниении разлагаются, выделяя сероводород.
Задание 15.4. Исходя из степени окисления атома серы в сероводороде, предcкажите, какие свойства будет проявлять этот атом в окислительно-восстановительных реакциях.
Поскольку сероводород — восстановитель (атом серы имеет низшую степень окисления), он легко окисляется. Кислород воздуха окисляет сероводород даже при комнатной температуре:
Сероводород горит:
Сероводород немного растворим в воде, причём его раствор проявляет свойства очень слабой кислоты (сероводородной H2S). Она образует соли сульфиды:
Вопрос. Как, имея сульфид, получить сероводород?
Сероводород в лабораториях получают, действуя на сульфиды более сильными (чем H2S) кислотами, например:
Физические свойства
Оксид серы(VI) — в обычных условиях легколетучая бесцветная жидкость с удушающим запахом.
Находящиеся в газовой фазе молекулы SO3 имеют плоское тригональное строение с симметрией D3h (угол OSO = 120°, d(S-O) = 141 пм). При переходе в жидкое и кристаллическое состояния образуются циклический тример и зигзагообразные цепи. Тип химической связи в молекуле: ковалентная полярная химическая связь.
Твёрдый SO3 существует в α-, β-, γ- и δ-формах, с температурами плавления соответственно 16,8, 32,5, 62,3 и 95 °C и различающихся по форме кристаллов и степени полимеризации SO3. α-Форма SO3 состоит преимущественно из молекул триме́ра. Другие кристаллические формы серного ангидрида состоят из зигзагообразных цепей: изолированных у β-SO3, соединенных в плоские сетки у γ-SO3 или в пространственные структуры у δ-SO3. При охлаждении из пара сначала образуется бесцветная, похожая на лёд, неустойчивая α-форма, которая постепенно переходит в присутствии влаги в устойчивую β-форму — белые «шёлковистые» кристаллы, похожие на асбест. Обратный переход β-формы в α-форму возможен только через газообразное состояние SO3. Обе модификации на воздухе «дымят» (образуются капельки H2SO4) вследствие высокой гигроскопичности SO3.
Взаимный переход в другие модификации протекает очень медленно. Разнообразие форм триоксида серы связано со способностью молекул SO3 полимеризоваться благодаря образованию донорно-акцепторных связей. Полимерные структуры SO3 легко переходят друг в друга, и твердый SO3 обычно состоит из смеси различных форм, относительное содержание которых зависит от условий получения серного ангидрида.
Приложения
Неорганические ангидриды имеют множество применений, от синтеза и создания материалов, керамики, катализаторов, цементов, электродов, удобрений и т. Д. До покрытия земной коры тысячами минералов железа и алюминия, а также диоксида. углерода, выдыхаемого живыми организмами.
Они представляют собой исходный источник, точку, где образуются многие соединения, используемые в неорганических синтезах. Одним из наиболее важных ангидридов является диоксид углерода, CO.2. Наряду с водой он необходим для фотосинтеза
А на промышленном уровне SO3 Это важно с учетом того, что из него получают требуемую серную кислоту
Возможно, ангидрид, который имеет наибольшее применение (пока есть жизнь), — это ангидрид фосфорной кислоты: аденозинтрифосфат, более известный как АТФ, присутствующий в ДНК и «энергетическая валюта» метаболизма.
Ссылки
- Редакторы Энциклопедии Британника. (2019). Ангидрид. Enclyclopaedia Britannica. Получено с: britannica.com
- Хельменстин, Энн Мари, доктор философии (8 января 2019 г.). Определение ангидрида кислоты в химии. Получено с: thinkco.com
- Химия LibreTexts. (н.д.). Ангидриды. Получено с: chem.libretexts.org
- Грэм Соломонс Т.В., Крейг Б. Фрайл. (2011). Органическая химия. Амины. (10th издание.). Wiley Plus.
- Кэри Ф. (2008). Органическая химия. (Издание шестое). Мак Гроу Хилл.
- Уиттен, Дэвис, Пек и Стэнли. (2008). Химия. (8-е изд.). CENGAGE Обучение.
- Моррисон и Бойд. (1987). Органическая химия. (Издание пятое). Аддисон-Уэсли Ибероамерикана.
- Википедия. (2019). Ангидрид органической кислоты. Получено с: en.wikipedia.org
Свойства ангидридов
Свойства ангидридов будут зависеть от того, какие из них вы имеете в виду. Общим для большинства из них является то, что они реагируют с водой. Однако, что касается так называемых основных ангидридов в неорганических соединениях, на самом деле некоторые из них даже нерастворимы в воде (MgO), поэтому это утверждение будет касаться ангидридов карбоновых кислот.
Точки плавления и кипения лежат в молекулярной структуре и межмолекулярных взаимодействиях для (RCO)2Или это общая химическая формула этих органических соединений.
Если молекулярная масса (RCO)2Или это низкая, вероятно, бесцветная жидкость при комнатной температуре и давлении. Например, уксусный ангидрид (или этановый ангидрид), (CH3CO)2Или это жидкость, имеющая огромное промышленное значение, поскольку ее производство очень обширно.
Реакция между уксусным ангидридом и водой представлена следующим химическим уравнением:
(CH3CO)2O + H2O => 2CH3COOH
Обратите внимание, что при добавлении молекулы воды выделяются две молекулы уксусной кислоты. Однако для уксусной кислоты обратная реакция невозможна:. 2CH3COOH => (CH3CO)2O + H2O (не встречается)
2CH3COOH => (CH3CO)2O + H2O (не встречается)
Необходимо прибегнуть к другому синтетическому маршруту. С другой стороны, дикарбоновые кислоты могут делать это при нагревании; но это будет объяснено в следующем разделе.
Особые свойства концентрированной H2SO4 :
1) Концентрированная серная кислота является сильным окислителем; при взаимодействии с металлами (кроме Au, Pt) восстанавливаться до S+4O2, S или H2S-2 в зависимости от активности металла. Без нагревания не реагирует с Fe, Al, Cr – пассивация. При взаимодействии с металлами, обладающими переменной валентностью, последние окисляются до более высоких степеней окисления, чем в случае с разбавленным раствором кислоты: Fe→Fe3+, Cr→Cr3+, Mn→ Mn4+,Sn→Sn4+
Активный металл
8 Al + 15 H2SO4(конц.)→4Al2(SO4)3 + 12H2O + 3H2S
4│2Al – 6e– → 2Al3+ – окисление
3│ S6+ + 8e → S2– восстановление
4Mg+ 5H2SO4 → 4MgSO4 + H2S + 4H2O
Металл средней активности
2Cr + 4 H2SO4(конц.)→ Cr2(SO4)3 + 4 H2O + S
1│ 2Cr – 6e →2Cr3+– окисление
1│ S6+ + 6e → S– восстановление
Металл малоактивный
2Bi + 6H2SO4(конц.)→ Bi2(SO4)3 + 6H2O + 3SO2
1│ 2Bi – 6e → 2Bi3+ – окисление
3│ S6+ + 2e →S4+ – восстановление
2Ag + 2H2SO4 →Ag2SO4 + SO2 + 2H2O
2) Концентрированная серная кислота окисляет некоторые неметаллы как правило до максимальной степени окисления, сама восстанавливается до S+4O2:
С + 2H2SO4(конц) → CO2 + 2SO2 + 2H2O
S+ 2H2SO4(конц) → 3SO2 + 2H2O
2P+ 5H2SO4(конц)→5SO2 + 2H3PO4 + 2H2O
3) Окисление сложных веществ:
Серная кислота окисляет HI и НВг до свободных галогенов:
2 КВr + 2Н2SO4 = К2SО4 + SO2 + Вr2 + 2Н2О
2 КI + 2Н2SО4 = К2SO4 + SO2 + I2 + 2Н2О
Концентрированная серная кислота не может окислить хлорид-ионы до свободного хлора, что дает возможность получать НСl по реакции обмена:
NаСl + Н2SO4(конц.) = NаНSO4 + НСl
Серная кислота отнимает химически связанную воду от органических соединений, содержащих гидроксильные группы. Дегидратация этилового спирта в присутствии концентрированной серной кислоты приводит к получению этилена:
С2Н5ОН = С2Н4 + Н2О.
Структура SO 3
Шаровидная модель циклического тримера SO 3
Ампула триоксида серы
И жидкий, и газообразный SO 3 существует в равновесии между мономером и циклическим тримером. Природа твердого SO 3 сложна, и известно по крайней мере 3 полиморфа , причем конверсия между ними зависит от следов воды.
Абсолютно чистый SO 3 замерзает при 16,8 ° C , чтобы дать Г -SO 3 форму, которая принимает конфигурацию циклического тримера [S (= O) 2 ( М = O)] 3 .
Если SO 3 конденсируется при температуре выше 27 ° C, то образуется -SO 3 , температура плавления которого составляет 62,3 ° C. α- SO 3 имеет волокнистый вид. По структуре это полимер [S (= O) 2 ( μ -O)] n . Каждый конец полимера оканчивается группами ОН. β- SO 3 , как и альфа-форма, является волокнистым, но разной молекулярной массы, состоит из полимера с гидроксильными группами, но плавится при 32,5 ° C. И гамма, и бета-формы являются метастабильными, в конечном итоге переходя в стабильную альфа-форму, если оставить их на некоторое время. Это преобразование вызвано следами воды.
Относительное давление паров твердого SO 3 составляет альфа <бета <гамма при одинаковых температурах, что указывает на их относительный молекулярный вес . Жидкий триоксид серы имеет давление пара, соответствующее гамма-форме. Таким образом, нагрев кристалла α- SO 3 до его точки плавления приводит к внезапному увеличению давления пара, которое может быть достаточно сильным, чтобы разбить стеклянный сосуд, в котором он нагревается. Этот эффект известен как «альфа-взрыв».
SO 3 агрессивно гигроскопичен . Теплота гидратации достаточна для воспламенения смеси SO 3 и дерева или хлопка. В таких случаях SO 3 обезвоживает эти углеводы .
Литература
- Ахметов Н. С. «Общая и неорганическая химия» М.: Высшая школа, 2001
- Карапетьянц М. Х., Дракин С. И. «Общая и неорганическая химия» М.: Химия 1994
Оксиды
| H2O | ||||||||||||||||
| Li2OLiCoO2Li3PaO4Li5PuO6Ba2LiNpO6LiAlO2Li3NpO4Li2NpO4Li5NpO6LiNbO3 | BeO | B2O3 | С3О2C12O9COC12O12C4O6CO2 | N2ONON2O3N4O6NO2N2O4N2O5 | O | F | ||||||||||
| Na2ONaPaO3NaAlO2Na2PtO3 | MgO | AlOAl2O3NaAlO2LiAlO2AlO(OH) | SiOSiO2 | P4OP4O2P2O3P4O8P2O5 | S2OSOSO2SO3 | Cl2OClO2Cl2O6Cl2O7 | ||||||||||
| K2OK2PtO3KPaO3 | CaOCa3OSiO4CaTiO3 | Sc2O3 | TiOTi2O3TiO2TiOSO4CaTiO3BaTiO3 | VOV2O3V3O5VO2V2O5 | FeCr2O4CrOCr2O3CrO2CrO3MgCr2O4 | MnOMn3O4Mn2O3MnO(OH)Mn5O8MnO2MnO3Mn2O7 | FeCr2O4FeOFe3O4Fe2O3 | CoFe2O4CoOCo3O4CoO(OH)Co2O3CoO2 | NiONiFe2O4Ni3O4NiO(OH)Ni2O3 | Cu2OCuOCuFe2O4Cu2O3CuO2 | ZnO | Ga2OGa2O3 | GeOGeO2 | As2O3As2O4As2O5 | SeOCl2SeOBr2SeO2Se2O5SeO3 | Br2OBr2O3BrO2 |
| Rb2ORbPaO3Rb4O6 | SrO | Y2O3YOFYOCl | ZrO(OH)2ZrO2ZrOSZr2О3Сl2 | NbONb2O3NbO2Nb2O5Nb2O3(SO4)2LiNbO3 | Mo2O3Mo4O11MoO2Mo2O5MoO3 | TcO2Tc2O7 | Ru2O3RuO2Ru2O5RuO4 | RhORh2O3RhO2 | PdOPd2O3PdO2 | Ag2OAg2O2 | Cd2OCdO | In2OInOIn2O3 | SnOSnO2 | Sb2O3Sb2O4Hg2Sb2O7Sb2O5 | TeO2TeO3 | I2O4I4O9I2O5 |
| Cs2OCs2ReCl5O | BaOBaPaO3BaTiO3BaPtO3 | HfO(OH)2HfO2 | Ta2OTaOTaO2Ta2O5 | WO2Br2WO2WO2Cl2WOBr4WOF4WOCl4WO3 | Re2OReORe2O3ReO2Re2O5ReO3Re2O7 | OsOOs2O3OsO2OsO4 | Ir2O3IrO2 | PtOPt3O4Pt2O3PtO2K2PtO3Na2PtO3PtO3 | Au2OAuOAu2O3 | Hg2OHgO(Hg3O2)SO4Hg2O(CN)2Hg2Sb2O7Hg3O2Cl2Hg5O4Cl2 | Tl2OTl2O3 | Pb2OPbOPb3O4Pb2O3PbO2 | BiOBi2O3Bi2O4Bi2O5 | PoOPoO2PoO3 | At | |
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | |
| ↓ | ||||||||||||||||
| La2O2SLa2O3 | Ce2O3CeO2 | PrOPr2O2SPr2O3Pr6O11PrO2 | NdONd2O2SNd2O3NdHO | Pm2O3 | SmOSm2O3 | EuOEu3O4Eu2O3EuO(OH)Eu2O2S | Gd2O3 | Tb | Dy2O3 | Ho2O3Ho2O2S | Er2O3 | Tm2O3 | YbOYb2O3 | Lu2O2SLu2O3LuO(OH) | ||
| Ac2O3 | UO2UO3U3O8 | PaOPaO2Pa2O5PaOS | ThO2 | NpONpO2Np2O5Np3O8NpO3 | PuOPu2O3PuO2PuO3PuO2F2 | AmO2 | Cm2O3CmO2 | Bk2O3 | Cf2O3 | Es | Fm | Md | No | Lr |
Органические ангидриды
Ангидриды кислот реагируют путем ацилирования либо со спиртом, с образованием сложного эфира, амина с образованием амида, либо ароматического кольца.
Существуют миллионы каждого из этих соединений и сотни тысяч вариантов карбоновых кислот для получения ангидрида; поэтому синтетические возможности резко возрастают.
Таким образом, одним из основных применений является включение ацильной группы в соединение с замещением одного из атомов или групп его структуры.
У каждого отдельного ангидрида есть свои собственные применения, но в целом все они реагируют одинаково. По этой причине эти типы соединений используются для модификации полимерных структур, создания новых полимеров; т.е. сополимеры, смолы, покрытия и т. д.
Например, уксусный ангидрид используется для ацетилирования всех групп ОН в целлюлозе (нижнее изображение). При этом каждый H группы OH заменяется ацетильной группой COCH.3.
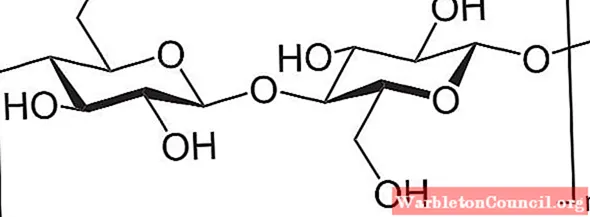
Таким образом получают полимер ацетата целлюлозы. Эту же реакцию можно описать и с другими полимерными структурами с NH-группами.2, также подвержены ацилированию.
Эти реакции ацилирования также полезны для синтеза лекарств, таких как аспирин (кислота ацетилсалициловый).
Способы получения и как применяется
Сернистую кислоту синтезируют с помощью растворения сернистого газа (SO2) в воде (H2O). Процесс можно наблюдать опытным путем. Необходимо взять концентрированную серную кислоту (H2SO4), медь (Cu) и пробирку. Алгоритм действий таков:
- аккуратно добавить в пробирку концентрированную серную кислоту;
- поместить в пробирку, содержащую кислоту, кусочек меди;
- смесь требуется нагреть.
Далее можно наблюдать реакцию, протекающую по уравнению:
Cu(медь)+2H2SO4(сернаякислота)=CuSO4(сульфатсеры)+SO2(сернистыйгаз)+H2O(вода)
Затем поток сернистого газа следует направить в пробирку с водой. При нахождении в ней газообразное вещество растворяется, частично протекает химическая реакция с водой. В итоге синтезируется сернистая кислота:
SO2(сернистыйгаз)+H2O(вода)=H2SO3
Таким образом с помощью пропускания сернистого газа через воду получают сернистую кислоту.
Сернистая кислота нашла применение в качестве восстановителя. Вещество используют для беления шерсти, шелка и других материалов, которые не способны выдержать отбеливание сильными окислителями в виде хлора. Сернистую кислоту используют в процессе консервирования плодов и овощей, а также для:
- обесцвечивания натуральных тканей, древесной массы, бумаги;
- консервации, антисептической обработки — к примеру, для защиты от ферментации зерна в производстве крахмала, предотвращения процесса брожения в бочках вина;
- переработки древесной щепы в сульфитную беленую целлюлозу, необходимую для изготовления бумаги.